题目内容
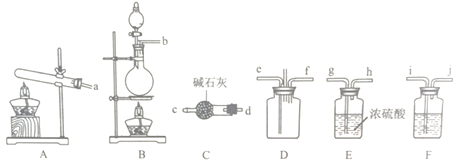
【题目】(1)写出下图中序号①~③仪器的名称:

①_________;② _________;③__________ ;
仪器①~④中,使用时必须检查是否漏水的有 _______.(填仪器序号)
(2)如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.

现用该浓硫酸配制480mL1molL-1的稀硫酸.请回答下列问题:
a. 该硫酸的物质的量浓度为__________molL-1
b.经计算,配制480mL1molL-1的稀硫酸需要用量筒量取上述浓硫酸的体积为_______mL;
c.配制过程中下列各项操作会导致所配稀硫酸浓度偏小的是_____(双选)
A.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
B.所选用的烧杯、玻璃棒未洗涤
C.定容时,俯视容量瓶刻度线
D.摇匀后静置发现液面低于刻度线,继续滴加蒸馏水至刻度处.
【答案】蒸馏烧瓶 冷凝管 分液漏斗 ③④ 18.4 27.2 BD
【解析】
(1)①为蒸馏装置,需要的仪器为蒸馏烧瓶、冷凝管、温度计、锥形瓶等,②为分液操作;③为容量瓶,结合仪器的结构分析;
分液漏斗、容量瓶使用时必须检查是否漏水;
(2)a.根据溶液的物质的量浓度c=1000ρω/M来计算;
b.根据溶液稀释定律c浓V浓=c稀V稀来计算;
c.分析操作对溶质物质的量、溶液体积的影响,根据c=n/V判断对所配溶液浓度的影响.
(1)根据仪器的结构特点,得到:①是蒸馏烧瓶,②是冷凝管,③是分液漏斗;④是容量瓶,故答案为:蒸馏烧瓶;冷凝管;分液漏斗;
分液漏斗、容量瓶使用时必须检查是否漏水;
故答案为:③④
(2)a.溶液的物质的量浓度c=1000ρω/M=1000mL/L×1.84g/mL×98%/98g·mol-1=18.4mol·L-1,
故答案为:18.4;
b.由于无480mL容量瓶,故选用500mL容量瓶,配制480mL 1mol·L-1的稀硫酸,设需要的浓硫酸的体积为VmL,根据溶液稀释定律c浓V浓=c稀V稀可知:18.4mol·L-1×VmL=1mol·L-1×500mL,解得V=27.2;
故答案为:27.2;
c.A、容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水,配制过程中需要滴加蒸馏水,故此无影响,故A不选;
B、所选用的烧杯、玻璃棒未洗涤,导致浓溶液物质的量偏小,根据c=n/V判断可知浓度偏低,故B选;
C、定容时,俯视容量瓶刻度线进行定容,故导致稀溶液体积偏小,根据c=n/V判断可知浓度偏高,故C不选;
D、定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处,导致稀溶液体积偏大,根据c=n/V判断可知浓度偏低,故D选;
故选BD。

【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
t ℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A. 该反应的化学方程式是:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
D. 某温度下,如果平衡浓度符合下列关系式:![]() =
=![]() ,判断此时的温度是1000 ℃
,判断此时的温度是1000 ℃