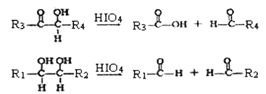
题目内容
【题目】氮元素有多种氧化物。请回答下列问题:
(1)已知:H2的燃烧热ΔH为-285.8kJ·mol-1。
N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol-1
H2O(g)=H2O(1) ΔH=-44kJ·mol-1
则4H2(g) + 2NO2(g) = 4H2O(g) + N2(g) ΔH=__________。
(2)一定温度下,向2L恒容密闭容器中充入0.40mol N2O4,发生反应:N2O4(g)![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/(mol·L-1) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①0-40s内,v(NO2)=________mol·L-1·s-1。
②升高温度时,气体颜色加深,则上述反应是________(填“放热”或“吸热”)反应。
③该温度下反应的化学平衡常数K=________mol·L-1。
④相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后c(NO2)________ (填“>”“=”或“<”)0.60mol·L-1。
(3)N2O5是绿色硝化试剂,溶于水可得硝酸。下图是以N2O4为原料电解制备N2O5的装置。写出阳极区生成N2O5的电极反应式(注意阳极区为无水环境,HNO3亦无法电离):________________________。

(4)湿法吸收工业尾气中的NO2,常选用烧碱溶液,产物为两种常见的含氧酸盐。该反应的离子方程式是____________________。
【答案】4H2(g)+2NO2(g)=N2(g)+4H2O(g) ΔH=-1100.2kJ·mol-1 0.005 吸热 1.8 < N2O4-2e-+2HNO3=2N2O5+2H+ 2NO2 + 2OH— = NO2— + NO3— + H2O
【解析】
(1)①H2(g)+1/2O2(g)═H2O(l);△H=-285.8kJ·mol-1,
②N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol-1
③H2O(g)=H2O(1) ΔH=-44kJ·mol-1
由盖斯定律①×4-②-③×4得:4H2(g)+2NO2(g)=N2(g)+4H2O(g) ΔH=-1100.2kJ·mol-1;
(2)①由速率公式计算。②根据平衡移动原理判断;③根据平衡常数表达式计算;④建立与原平衡放大2倍的等效平衡,然后将体积缩小到与原平衡相同。
(3)阳极发生氧化反应,注意非水体系,硝酸写化学式;
(4)湿法吸收工业尾气中的NO2,常选用烧碱溶液,产物为两种常见的含氧酸盐,硝酸盐和亚硝酸盐。写出反应方程式。
(1)①H2(g)+1/2O2(g)═H2O(l);△H=-285.8kJ·mol-1,
②N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol-1
③H2O(g)=H2O(1) ΔH=-44kJ·mol-1
由盖斯定律①×4-②-③×4得:4H2(g)+2NO2(g)=N2(g)+4H2O(g) ΔH=-285.8KJ·mol-1×4-133kJ·mol-1+44kJ·mol-1×4=-1100.2kJ·mol-1;
(2) N2O4(g)![]() 2NO2(g)
2NO2(g)
c始(mol·L-1) 0.2 0
c变(mol·L-1) 0.15 0.3
c平(mol·L-1 ) 0.05 0.3
①0-40s内,v(NO2)=0.2mol·L-1÷40s=0.005mol·L-1·s-1。
②升高温度时,气体颜色加深,平衡正向移动,则上述反应是吸热反应。
③该温度下反应的化学平衡常数K=![]() =1.8mol·L-1。
=1.8mol·L-1。
④相同温度下,若开始向该容器中充入0.80molN2O4,相当于将原平衡放大2倍,然后加压,平衡逆向移动,则达到平衡后c(NO2)<0.60mol·L-1。
(3)以N2O4为原料电解制备N2O5,N2O4失电子被氧化,阳极区生成N2O5的电极反应式为:N2O4-2e-+2HNO3=2N2O5+2H+。
(4)湿法吸收工业尾气中的NO2,常选用烧碱溶液,产物为两种常见的含氧酸盐,硝酸盐和亚硝酸盐,该反应的离子方程式是2NO2 + 2OH— = NO2— + NO3— + H2O。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案