题目内容
【题目】已知:A、B、C、D、E、F为周期表中前四周期的七种元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同。
请回答下列问题:
(1)D元素的原子中存在________种运动状态的电子;
(2)在A元素与上述其他元素形成的分子中,其中心原子为sp3杂化的为________(写出2种即可)
(3)与C同族且位于第四周期元素所形成简单气态氢化物的电子式为________;其与C的简单气态氢化物相比稳定性更________(填“强”或“弱”);
(4)F的基态原子核外电子排布式是_____________________________;其在元素周期表中的位置是:_______________________________;
(5)E原子的第一电离能比同周期后面相邻元素的第一电离能________(填“大”或“小”)。
【答案】8CH4、NH3 、H2O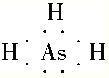 弱1s22s22p63s23p63d24s2或[Ar]3d24s2第四周期第IVB族大
弱1s22s22p63s23p63d24s2或[Ar]3d24s2第四周期第IVB族大
【解析】
A是周期表中原子半径最小的元素,即A是H,B的基态原子有3个不同的能级,各能级中电子数相等,即B的电子排布式为1s22s22p2,B为C,D的基态原子2p能级上未成对电子数与B原子的相同,且D的离子为-2价,即D为O,O2-与E2+具有相同的电子层结构,即E为Mg,F4+与氩原子的核外电子排布相同,即F的原子序数为22,即为Ti,(1)D为O,核外有8个电子,有8种运动状态不同的电子;(2)sp3杂化说明价层电子对数为4,符合条件的是CH4、NH3、H2O等;(3)七种元素原子序数依次增大,即C为N,与N同主族,且位于第四周期,即该元素为As,其氢化物的电子式类似NH3的电子式,即为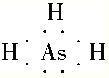 ,N的非金属性强于As,则NH3的稳定性强于AsH3;(4)F为Ti,位于第四周期IVB族,核外电子排布式为1s22s22p63s23p63d24s2或[Ar]3d24s2;(5)同周期从左向右第一电离能增大,但IIA>IIIA,VA>VIA,因此Mg的第一电离能大于Al。
,N的非金属性强于As,则NH3的稳定性强于AsH3;(4)F为Ti,位于第四周期IVB族,核外电子排布式为1s22s22p63s23p63d24s2或[Ar]3d24s2;(5)同周期从左向右第一电离能增大,但IIA>IIIA,VA>VIA,因此Mg的第一电离能大于Al。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】氮元素有多种氧化物。请回答下列问题:
(1)已知:H2的燃烧热ΔH为-285.8kJ·mol-1。
N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol-1
H2O(g)=H2O(1) ΔH=-44kJ·mol-1
则4H2(g) + 2NO2(g) = 4H2O(g) + N2(g) ΔH=__________。
(2)一定温度下,向2L恒容密闭容器中充入0.40mol N2O4,发生反应:N2O4(g)![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/(mol·L-1) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①0-40s内,v(NO2)=________mol·L-1·s-1。
②升高温度时,气体颜色加深,则上述反应是________(填“放热”或“吸热”)反应。
③该温度下反应的化学平衡常数K=________mol·L-1。
④相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后c(NO2)________ (填“>”“=”或“<”)0.60mol·L-1。
(3)N2O5是绿色硝化试剂,溶于水可得硝酸。下图是以N2O4为原料电解制备N2O5的装置。写出阳极区生成N2O5的电极反应式(注意阳极区为无水环境,HNO3亦无法电离):________________________。

(4)湿法吸收工业尾气中的NO2,常选用烧碱溶液,产物为两种常见的含氧酸盐。该反应的离子方程式是____________________。








