��Ŀ����
����Ŀ���л������������ȡ��Ĺ�Ч����ϳ�·�����£�
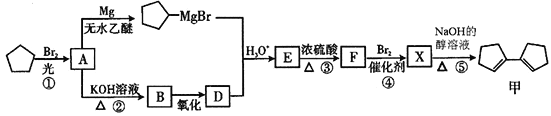
��֪��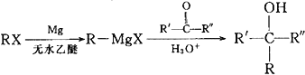 (R��R'��R"������������)
(R��R'��R"������������)
��1���л���ķ���ʽΪ___________���л���A�к��еĹ����ŵ�����Ϊ_______________��
��2���л���B��������__________����B��D ����ķ�Ӧ�Լ��ͷ�Ӧ����Ϊ________________��
��3����������~�ݷ�Ӧ�У�����ȡ����Ӧ����____________(�����)��
��4��д��E��F�Ļ�ѧ����ʽ________________��
��5�����������ڷ����廯�������ļ�ͬ���칹����________�֡����к˴Ź���������ֻ��2���Ľṹ��ʽ��______________
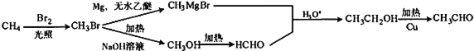
��6�����������Ϣ��д����CH4Ϊԭ���Ʊ�CH3CHO�ĺϳ�·�ߣ������Լ���ѡ��__________________��
���𰸡�C10H14��ԭ�ӻ��촼���� Cu/Ag�����Ȣ٢�![]() 22
22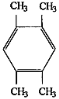
��������
������Ϣ֪����������巢��ȡ����Ӧ����A��AΪ![]() ��A��KOH��ˮ��Һ����ˮ�ⷴӦ����B��BΪ
��A��KOH��ˮ��Һ����ˮ�ⷴӦ����B��BΪ![]() ��B����������DΪ
��B����������DΪ![]() ��������Ϣ֪����E��EΪ
��������Ϣ֪����E��EΪ![]() ��E������ȥ��Ӧ����F��FΪ
��E������ȥ��Ӧ����F��FΪ![]() ��F���巢���ӳɷ�Ӧ����X��XΪ
��F���巢���ӳɷ�Ӧ����X��XΪ![]() ��X������ȥ��Ӧ���ɼס�
��X������ȥ��Ӧ���ɼס�
��1�����ݼĽṹ��ʽ֪���л���ķ���ʽΪC10H14��AΪ![]() ���л���A�к��еĹ����ŵ�����Ϊ��ԭ�ӣ��ʴ�Ϊ��C10H14����ԭ�ӣ�
���л���A�к��еĹ����ŵ�����Ϊ��ԭ�ӣ��ʴ�Ϊ��C10H14����ԭ�ӣ�
��2��BΪ![]() ��B�������ǻ��촼����B��DΪ���Ĵ�������Ӧ������ķ�Ӧ�Լ�Ϊ��������Ӧ����ΪCu/Ag�����ȣ��ʴ�Ϊ�����촼��������Cu/Ag�����ȣ�
��B�������ǻ��촼����B��DΪ���Ĵ�������Ӧ������ķ�Ӧ�Լ�Ϊ��������Ӧ����ΪCu/Ag�����ȣ��ʴ�Ϊ�����촼��������Cu/Ag�����ȣ�
��3�������������ݷ�Ӧ�У�����ȡ����Ӧ���Т٢ڣ��ʴ�Ϊ���٢���
��4��EΪ![]() ��E������ȥ��Ӧ����FΪ
��E������ȥ��Ӧ����FΪ![]() ����Ӧ����ʽΪ
����Ӧ����ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��5������C10H14����ͬ���칹�������ڷ����廯���˵�����б������ٱ���������1����������������������4�֣��ڱ���������2������������λ����λ�Ͷ�λ��2�����������Ǽ��������������������3����2������Ϊ�һ���3�֣���9�����۱���������3��������2������1���һ�����6�֣��ܱ���������4������3�֣���22�֣����к˴Ź���������ֻ��2��壬˵������������ԭ�ӣ��ṹ��ʽΪ![]() ���ʴ�Ϊ��22��
���ʴ�Ϊ��22��![]() ��
��
��6��CH4���巢��ȡ����Ӧ����CH3Br��CH3Br��Mg����ˮ�Ҵ���Ӧ����CH3MgBr��CH3Br��NaOH��ˮ��Һ��������CH3OH��CH3OH������������Ӧ����HCHO��HCHO��CH3MgBr��Ӧ�ữ�õ�CH3CH2OH��CH3CH2OH��������������CH3CHO����ϳ�·��Ϊ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��

����Ŀ����Ԫ���ж����������ش��������⣺
��1����֪��H2��ȼ���Ȧ�HΪ��285.8kJ��mol��1��
N2(g)��2O2(g)��2NO2(g) ��H����133kJ��mol��1
H2O(g)��H2O(1) ��H����44kJ��mol��1
��4H2(g) + 2NO2(g) = 4H2O(g) + N2(g) ��H��__________��
��2��һ���¶��£���2L�����ܱ������г���0.40mol N2O4��������Ӧ��N2O4(g)![]() 2NO2(g)��һ��ʱ���ﵽƽ�⣬����������£�
2NO2(g)��һ��ʱ���ﵽƽ�⣬����������£�
ʱ�䣯s | 20 | 40 | 60 | 80 | 100 |
c(NO2)��(mol��L��1) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
��0��40s�ڣ�v(NO2)��________mol��L��1��s��1��
�������¶�ʱ��������ɫ�����������Ӧ��________(����ȡ������ȡ�)��Ӧ��
�۸��¶��·�Ӧ�Ļ�ѧƽ�ⳣ��K��________mol��L��1��
����ͬ�¶��£�����ʼ��������г���0.80molN2O4����ﵽƽ���c(NO2)________ (���������������)0.60mol��L��1��
��3��N2O5����ɫ�����Լ�������ˮ�ɵ����ᡣ��ͼ����N2O4Ϊԭ�ϵ���Ʊ�N2O5��װ�á�д������������N2O5�ĵ缫��Ӧʽ(ע��������Ϊ��ˮ������HNO3��������)��________________________��

��4��ʪ�����չ�ҵβ���е�NO2����ѡ���ռ���Һ������Ϊ���ֳ����ĺ������Ρ��÷�Ӧ�����ӷ���ʽ��____________________��


