题目内容
【题目】已知N2O4和NO2可以相互转化:2NO2(g) ![]() N2O4(g) △H<0现将一定量N2O4和NO2的混合气体通入体积为2L的恒温密闭玻璃容器中,发生反应,各物质浓度随时间变化关系如图:
N2O4(g) △H<0现将一定量N2O4和NO2的混合气体通入体积为2L的恒温密闭玻璃容器中,发生反应,各物质浓度随时间变化关系如图:
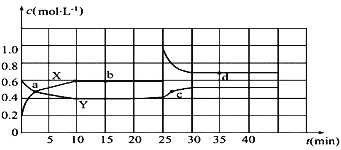
(1)图中曲线______(填“X”或“Y”)表示c(N2O4)随时间的变化。
(2)从起点开始首次达到平衡时,以NO2表示的反应速率为______。
(3)图中b点的平衡常数K的值为________。
(4)其他条件不变,若起始时向该容器中通入0.4molN2O4和0.2molNO2,则v正_____v逆(填“>”、“=”或“<”);若升温该反应的平衡常数K______(填“增大”、“减小”或“不变”) ,判断理由是_________________。
(5)25min时,改变的外界条件是______,图象中a、b、c、d四点中v正=v逆的点是____,四点中________点体系颜色最深。
【答案】(1)Y;(2)0.04mol/(L·min);(3)1.1;(4)<;减小;N2O4分解NO2是吸热反应,温度升高,平衡左移,平衡常数减小;(5)增大NO2的浓度;bd;c。
【解析】
试题分析:(1)根据反应方程式2NO2(g) ![]() N2O4(g) △H<0可知:在相同时间内NO2、N2O4改变的物质的量的比是2:1,由图像可知Y变化的小于X,实验Y表示的是c(N2O4)随时间的变化;(2)从起点开始首次达到平衡时,反应时间是10min,以NO2表示的反应速率为v(NO2)=(0.6mol/L-0.2mol/L)÷10min=0.04mol/(L·min);(3)图中b点时,c(NO2)=0.6mol/L,c(N2O4)=0.4mol/L。所以此时的平衡常数K=c(N2O4)÷c2(NO2)= 0.4mol/L÷(0.6mol/L)2=0.4÷0.36=1.1;(4)其他条件不变,若起始时向该容器中通入0.4molN2O4和0.2molNO2,c(N2O4)=0.4mol÷2L=0.2mol/L;c(NO2)=0.2mol÷2L=0.1mol/L,Qc= c(N2O4)÷c2(NO2)= 0.2mol/L÷(0.1mol/L)2=0.2÷0.01=20>1.1;则v正<v逆;由于该反应的正反应是放热反应,所以若升温,化学平衡逆向移动,该反应的平衡常数K减小,判断理由是N2O4分解NO2是吸热反应,温度升高,平衡左移,平衡常数减小;(5)根据图像可知,在25min时,c(N2O4)不变,而c(NO2)突然增大,可见改变的外界条件是增大NO2的浓度,图象中a、b、c、d四点中v正=v逆的点是反应处于平衡时的点,是b、d点;反应开始时是反应逆向进行,不断产生NO2,到b点时达到平衡状态,此时c(NO2)比a点大,在c点时增大c(NO2)的浓度,反应正向移动,又使NO2的浓度有所减小,所以四点中c点c(NO2)增大,体系颜色最深。
N2O4(g) △H<0可知:在相同时间内NO2、N2O4改变的物质的量的比是2:1,由图像可知Y变化的小于X,实验Y表示的是c(N2O4)随时间的变化;(2)从起点开始首次达到平衡时,反应时间是10min,以NO2表示的反应速率为v(NO2)=(0.6mol/L-0.2mol/L)÷10min=0.04mol/(L·min);(3)图中b点时,c(NO2)=0.6mol/L,c(N2O4)=0.4mol/L。所以此时的平衡常数K=c(N2O4)÷c2(NO2)= 0.4mol/L÷(0.6mol/L)2=0.4÷0.36=1.1;(4)其他条件不变,若起始时向该容器中通入0.4molN2O4和0.2molNO2,c(N2O4)=0.4mol÷2L=0.2mol/L;c(NO2)=0.2mol÷2L=0.1mol/L,Qc= c(N2O4)÷c2(NO2)= 0.2mol/L÷(0.1mol/L)2=0.2÷0.01=20>1.1;则v正<v逆;由于该反应的正反应是放热反应,所以若升温,化学平衡逆向移动,该反应的平衡常数K减小,判断理由是N2O4分解NO2是吸热反应,温度升高,平衡左移,平衡常数减小;(5)根据图像可知,在25min时,c(N2O4)不变,而c(NO2)突然增大,可见改变的外界条件是增大NO2的浓度,图象中a、b、c、d四点中v正=v逆的点是反应处于平衡时的点,是b、d点;反应开始时是反应逆向进行,不断产生NO2,到b点时达到平衡状态,此时c(NO2)比a点大,在c点时增大c(NO2)的浓度,反应正向移动,又使NO2的浓度有所减小,所以四点中c点c(NO2)增大,体系颜色最深。

 名校课堂系列答案
名校课堂系列答案【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等.实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如图:
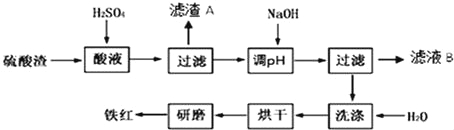
(1)硫酸渣的成分中既能与酸又能与碱反应的是 ,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: .
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是 (部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(3)滤渣A的主要成分为 ,滤液B含有的主要物质有 .
(4)如何证明洗涤环节充分洗净 .
(5)已知硫酸渣质量为a kg,假设铁红制备过程中铁元素损耗25%,最终得到铁红的质量为b kg,则原来硫酸渣中铁元素质量分数为 .(用题中所给数据计算并用最简整数比表示结果)