题目内容
【题目】X、Y、Z为不同短周期非金属元素的气态单质。在一定条件下能发生反应:Y+X![]() 甲(g) , Y+Z
甲(g) , Y+Z![]() 乙(g)。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。
乙(g)。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。
(1)X的结构式是___________。
(2)磷在Z气体中燃烧可生成液态丙(PZ3)分子,也可生成固态丁(PZ5)分子。磷单质和Z单质反应生成lmol丙时,反应过程与能量变化如图I所示,该反应的热化学方程式是____________。已知1mol白磷固体和Z气体反应,生成固态丁时,放热399kJ,则1mol固态丁转化为丙时的反应热△H=_________
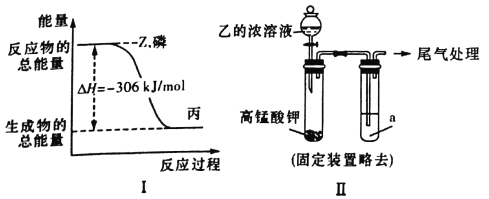
(3)某同学拟用图II所示装置证明氧化性Z>I2,已知高锰酸钾与乙的浓溶液反应生成Z,则a是_______的水溶液。若仅将a换为甲的浓溶液,实验时会产生大量白烟并有气体单质生成,该反应的化学方程式是____。
(4)向一定浓度的BaCl2溶液中通入SO2气体,未见沉淀生成,若在通入SO2气体的同时加入由X、Y、Z中的一种或几种元素组成的某纯净物,即可生成白色沉淀,该纯净物可能是________、________。
【答案】(1)N≡N;(2)2P(s)+3Cl2(g)=2PCl3(l) △H=- 612 kJ/mol;+93 kJ/mol;
(3)淀粉KI或KI;8NH3+3Cl2![]() 6NH4Cl+N2;(4)Cl2(1分);NH3(1分)。
6NH4Cl+N2;(4)Cl2(1分);NH3(1分)。
【解析】
试题分析:X、Y、Z为不同短周期非金属元素的气态单质,Y+X→甲(g),Y+Z→乙(g).甲、乙可化合生成离子化合物,则该化合物为NH4Cl,甲的相对分子质量小于乙,则甲为NH3,乙为HCl,Y为H2,X为N2,Z为Cl2。(1)X为N2,氮原子之间有3对共用电子对,结构为N≡N;(2)P在氯气中燃烧可生成PCl3或PCl5,根据图像可知 P(s)+3/2Cl2(g)总能量大于1molPCl3的能量,反应放热,所以热化学方程式为:P(s)+ 3/2Cl2(g)=PCl3(l) △H=- 306 kJ/mol①;已知1mol白磷固体和Z气体反应,生成固态丁时,放热399kJ,可得热化学方程式是:P(s)+5/2Cl2(g)= PCl5(s),△H=- 399kJ/mol ②,①-②整理可得PCl5(s)= PCl3(l)+ Cl2(g) △H=+93 kJ/mol;(3)氯气的氧化性大于碘的氧化性,将氯气通入淀粉KI溶液中生成碘单质,溶液变蓝,氯气具有强氧化性,与过量氨气反应生成NH4Cl和N2,反应的方程式为8NH3+3Cl2=6NH4Cl+N2,所以溶液a是淀粉KI或KI;该反应的化学方程式是:8NH3+ 3Cl2 ![]() 6NH4Cl+N2;(4)若在通入SO2气体的同时加入Cl2,发生反应为SO2+ Cl2+2H2O═H2SO4+2HCl,在BaCl2溶液中生成BaSO4沉淀,若在通入SO2气体的同时加入NH3,溶液中存在大量的SO32-,可生成沉淀BaSO3,故通入的气体可以是Cl2或NH3。
6NH4Cl+N2;(4)若在通入SO2气体的同时加入Cl2,发生反应为SO2+ Cl2+2H2O═H2SO4+2HCl,在BaCl2溶液中生成BaSO4沉淀,若在通入SO2气体的同时加入NH3,溶液中存在大量的SO32-,可生成沉淀BaSO3,故通入的气体可以是Cl2或NH3。