题目内容
【题目】某温度下,向一定体积0.1mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示则
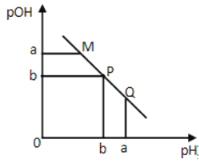
A.M点所示溶液的导电能力强于Q点
B.N点所示溶液中c(CH3COO-)>c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
【答案】C
【解析】
试题分析:A.由于醋酸是弱酸,电离程度很小,离子浓度也较小,M点溶液的导电能力最弱,A错误;B.N点所示溶液为碱性,根据溶液电荷守恒易判断出此时c(Na+)>c(CH3COO-),B错误;C.由于M点的H+浓度等于N点的OH-浓度,对水的电离程度抑制能力相同,所以两点水电离程度相同,C正确;D.Q点的pOH=pH,溶液为中性,而两者等体积混合后生成醋酸钠,水解显碱性.则所加NaOH溶液体积略小于醋酸溶液的体积,D错误;答案选C。

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目