题目内容
【题目】Ⅰ. (1)用锌片,铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25g,铜表面析出了氢气________L(标准状况下),导线中通过________mol电子。
(2) 将ag Na投入到bg D2O(足量)中,反应后所得溶液的密度为dg/cm3,则该溶液物质的量浓度是_______;
Ⅱ. 将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g)。反应进行到10 s末时,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol,则:
(1)用C表示10 s内正反应的平均反应速率为____________。
(2)反应前A的物质的量浓度是________。
(3)10 s末,生成物D的浓度为________。
【答案】1.12 0.1 ![]() mol/L 0.04molL-1s-1 1.5molL-1 0.4molL-1
mol/L 0.04molL-1s-1 1.5molL-1 0.4molL-1
【解析】
Ⅰ.(1)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,锌为负极,电极反应为:Zn-2e-=Zn2+,铜为正极,电极反应为2H++2e-=H2↑,锌片的质量减少了3.25克,则物质的量为![]() =0.05mol,转移的电子的物质的量为n(e-)=2n(Zn)=2n(H2)=2×0.05mol=0.1mol,则V(H2)=0.05mol×22.4L/mol=1.12L,故答案为:1.12;0.1;
=0.05mol,转移的电子的物质的量为n(e-)=2n(Zn)=2n(H2)=2×0.05mol=0.1mol,则V(H2)=0.05mol×22.4L/mol=1.12L,故答案为:1.12;0.1;
(2)将ag Na投入到bg D2O(足量)中,发生2Na+2D2O=2NaOD+D2↑,ag Na的物质的量为![]() =
=![]() mol,生成的氢氧化钠为
mol,生成的氢氧化钠为![]() mol,D2的物质的量为
mol,D2的物质的量为![]() mol,质量为
mol,质量为![]() mol×4g/mol=
mol×4g/mol=![]() g,反应后溶液的质量为ag+bg-
g,反应后溶液的质量为ag+bg-![]() g=(a+b-
g=(a+b-![]() )g,溶液的体积为
)g,溶液的体积为 =
=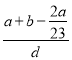 cm3,则该溶液物质的量浓度c=
cm3,则该溶液物质的量浓度c=![]() =
= =
=![]() mol/L,故答案为:
mol/L,故答案为:![]() mol/L;
mol/L;
Ⅱ.(1)v(C)= =0.04molL-1s-1,故答案:0.04molL-1s-1;
=0.04molL-1s-1,故答案:0.04molL-1s-1;
(2)3A(g)+B(g)2C(g)+2D(g)。反应进行到10 s末时,测得A的物质的量为1.8 mol,C的物质的量为0.8 mol,则反应的A为1.2mol,反应前A的物质的量浓度是![]() =1.5molL-1,故答案为:1.5molL-1;
=1.5molL-1,故答案为:1.5molL-1;
(3)3A(g)+B(g)2C(g)+2D(g)。反应进行到10 s末时,测得C的物质的量为0.8 mol,则生成的D为0.8 mol ,10 s末,生成物D的浓度为![]() =0.4molL-1,故答案为:0.4molL-1。
=0.4molL-1,故答案为:0.4molL-1。





