题目内容
【题目】某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和K2SO4溶液。下列说法正确的是( )
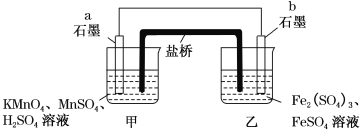
A. b电极上发生还原反应
B. 外电路电流方向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. a电极上发生的反应为MnO4-+8H++5e-=Mn2++4H2O
【答案】BD
【解析】
原电池中负极失去电子,电子经外电路流向正极,正极发生得电子反应。溶液中和盐桥内,阳离子移向正极,阴离子移向负极。
从电池总反应看,FeSO4失电子生成Fe2(SO4)3,石墨b为负极,发生氧化反应(A项错误),电极反应为Fe2+-e-=Fe3+;KMnO4得电子生成MnSO4,石墨a为正极,发生还原反应,电极反应为MnO4-+8H++5e-=Mn2++4H2O(D项正确)。外电路中,电子从负极b流向正极a,则电流从正极a流向负极b(B项正确)。溶液中和盐桥内,阳离子(K+等)移向正极a所在的甲烧杯,阴离子(SO42-等)移向负极b所在的乙烧杯(C项错误)。
本题选BD。

练习册系列答案
相关题目