题目内容
2. (1)乙醇的分子结构如图,其中①②③④⑤表示化学键的代号,用代号回答:
(1)乙醇的分子结构如图,其中①②③④⑤表示化学键的代号,用代号回答:i乙醇与钠反应断裂的键是⑤
ii乙醇与氧气在铜或银作催化剂,加热条件下反应断裂的键是③⑤
(2)把一端弯成螺旋状的铜丝放在酒精灯外焰部分加热,看到铜丝表面变成黑色,这是因为生成了CuO.趁热将它反复插入盛乙醇的试管中,铜丝表面又变成红色,并有刺激性气味的物质生成,总反应的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
分析 (1)i.乙醇与与金属钠反应生成乙醇钠和氢气,断开的羟基上的氢氧键;
ii.乙醇在铜或银作催化下与O2反应生成乙醛和水,断开的是羟基上的氢氧键和与羟基所连的碳的氢;
(2)金属铜在乙醇氧化生成乙醛的反应中作催化剂,螺旋状的铜丝放在酒精灯外焰部分加热,铜被氧气氧化为黑色氧化铜,氧化铜能将乙醇氧化为乙醛,自身被还原成铜.
解答 解:(1)i.乙醇与与金属钠反应生成乙醇钠和氢气,断开的羟基上的氢氧键,即⑤断裂;
故答案为:⑤;
ii.乙醇在铜或银作催化下与O2反应生成乙醛和水,断开的是羟基上的氢氧键和与羟基所连的碳的氢,
即③⑤断裂;
故答案为:③⑤;
(2)把一端弯成螺旋状的铜丝放在酒精灯外焰部分加热,铜被氧气氧化为黑色CuO,立即将它插入盛乙醇的试管,
氧化铜能将乙醇氧化为乙醛,同时由黑色氧化铜又变成红色铜,试管中有刺激性气味的乙醛生成,金属铜在反应中作催化剂,反应的方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
故答案为:黑;CuO;红;刺激性;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
点评 本题考查了乙醇的结构和性质,题目难度不大,注意把握反应机理,以及官能团与有机物性质的关系.

练习册系列答案
相关题目
13.某烃结构式如下: ,有关其结构说法正确的是( )
,有关其结构说法正确的是( )
 ,有关其结构说法正确的是( )
,有关其结构说法正确的是( )| A. | 所有原子可能在同一平面上 | B. | 所有碳原子可能在同一平面上 | ||
| C. | 有7个碳原子在同一条直线上 | D. | 有5个碳原子在同一直线上 |
10.科学家预测原子序数为114的元素具有相当稳定的核素,它在元素周期表中的位置在第7周期ⅣA族,位于铅的下方,称为类铅.下列关于它的性质叙述中,错误的是( )
| A. | 它的最高价氧化物的水化物是强酸 | B. | 它的金属性比铅强 | ||
| C. | 它具有7个电子层 | D. | 它的最外层电子数为4 |
17.某元素最高价氧化物对应水化物的化学式为H2XO3,这种元素的气态氢化物的化学式是( )
| A. | HX | B. | XH4 | C. | XH3 | D. | H2X |
7.化学工艺中倡导无污染的绿色化学是一场新的技术革命.若使用单质铜制硝酸铜,下列方案中,耗用原料最经济,而且对环境几乎没有污染的是( )
| A. | Cu和稀硝酸反应制Cu(NO3)2 | |
| B. | Cu和浓硝酸反应制Cu(NO3)2 | |
| C. | 铜在空气中受热转化为CuO,再溶于稀硝酸制Cu(NO3)2 | |
| D. | 铜在氧气中受热转化为CuO,再溶于浓硝酸制Cu(NO3)2 |
14.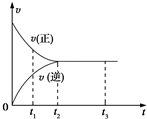 图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
 图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,V(正)>V(逆) | B. | t1~t2,X2的物质的量越来越多 | ||
| C. | t2~t3,各物质的浓度不再发生变化 | D. | t2~t3,反应不再发生 |
12.氢氧燃料电池已用于航天飞机.该电池的构造示意图如图,有关说法错误的是( )

| A. | 供电时的总反应为2H2+O2=2H2O | |
| B. | 负极电极反应为2H2+4OH--4e-=4H2O | |
| C. | 正极电极反应为O2+2H2O+4e-=4OH- | |
| D. | 该燃料电池的能量转化率可达100% |
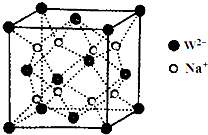 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:


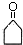 ,G中官能团的名称为酯基、碳碳双键.
,G中官能团的名称为酯基、碳碳双键. +CH3CHO$\stackrel{碱}{→}$
+CH3CHO$\stackrel{碱}{→}$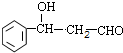 ,反应类型加成反应.
,反应类型加成反应.