题目内容
【题目】25℃时,向10mL0.10mol·L-1的一元弱酸HA(Ka=1.0×10-3)中逐滴加入0.10mol·L-1NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法正确的是( )
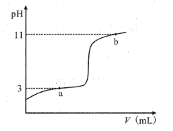
A. a点时,c(HA)+c(OH-)=c(Na+)+c(H+)
B. 溶液在a点和b点时水的电离程度相同
C. b点时,c(Na+)=c(HA)+c(A-)+c(OH-)
D. V=10mL时,c(Na+)>c(A-)>c(H+)>c(HA)
【答案】A
【解析】
A选项,a点时,pH=3, c(H+) =1.0×10-3 mol·L-1,因为Ka =1.0×10-3,所以c(HA) = c(A_),根据电荷守恒c(A_) + c(OH_) = c(Na+) + c(H+)和c(HA) = c(A_),故A正确;
B选项,a点溶质为HA和NaA,pH=3,c(H+) = 1.0×10-3mol·L-1,c(OH_)=10_11 mol·L-1,则水电离出的c(OH_)=10_11 mol·L-1,b点溶质为NaOH和NaA,pH=11,c(H+) =1.0×10-11 mol·L-1,c(OH_)=10_3 mol·L-1,则水电离出的c(OH_)=10_11 mol·L-1,两者水电离出的氢氧根离子浓度相等,故B正确;
C选项,根据电荷守恒c(Na+) + c(H+) = c(A_) + c(OH_)可得c(Na+) = c(A_) + c(OH_)-c(H+),假设C选项成立,则c(A_) + c(OH_)-c(H+) = c(HA) + c(A_ ) + c(OH_),推出c(HA) + c(H+) = 0,故假设不成立,故C错误;
D选项,V =10mL 时,HA与NaOH恰好完全反应生成NaA,A_ + H2O HA +OH_ ,水解后溶液显碱性,c(OH_) > c(H+), 即c(HA) > c(H+),故D错误。
综上所述,答案为AB。

【题目】探究2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O反应速率的影响因素,有关实验数据如下表所示:
实验 编号 | 温度 (℃) | 催化剂用量(g) | 酸性KMnO4溶液 | H2C2O4溶液 | KMnO4 溶液褪色平均时间(min) | ||
体积 (mL) | 浓度 (mol·L-1) | 体积 (mL) | 浓度 (mol·L-1) | ||||
1 | 25 | 0.5 | 4 | 0.1 | 8 | 0.2 | 12.7 |
2 | 80 | 0.5 | 4 | 0.1 | 8 | 0.2 | a |
3 | 25 | 0.5 | 4 | 0.01 | 8 | 0.2 | 6.7 |
4 | 25 | 0 | 4 | 0.01 | 8 | 0.2 | b |
下列说法不正确的是
A.反应速率:v(实验3) > v(实验1)
B.a<12.7,b>6.7
C.用H2C2O4表示实验1的反应速率:v(H2C2O4)≈6.6×l0-3mol·L-1·min-1
D.相同条件下可通过比较收集相同体积CO2所消耗的时间来判断反应速率快慢