题目内容
【题目】铝与过量的稀盐酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是( )
A.降低温度
B.加入适量的水
C.加入少量CuSO4溶液
D.加入浓度较大的盐酸
【答案】D
【解析】解:A.降低温度,反应速率减小,故A不选; B.加入适量的水,氢离子浓度减小,反应速率减小,故B不选;
C.加入少量CuSO4溶液,Al置换出Cu,构成原电池加快反应速率,但Al与酸反应生成的氢气减少,故C不选;
D.加入浓度较大的盐酸,氢离子浓度增大,反应速率加快,且生成氢气不变,故D选;
故选D.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应.应用如图装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 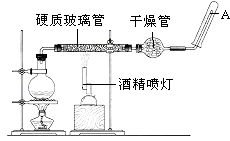
请回答下列的问题.
(1)铁在周期表中的位置是 .
(2)请写出该反应的化学方程式: .
(3)曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为 .
(4)现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含b mol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO.试回答下列问题: ①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
① | ② | ③ | ④ | |
溶液中的金属离子 | Fe2+ | |||
残留固体成分 | Fe、Pt | Pt | Pt |
②当x=0.5,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生112mL NO.则a= , b= .