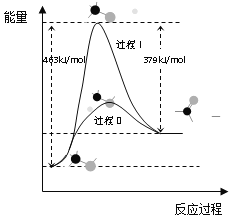
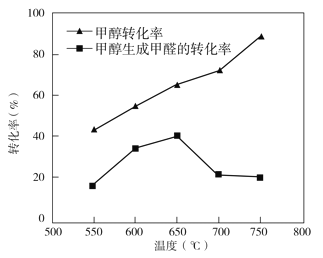
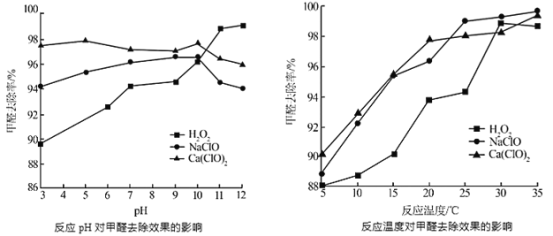
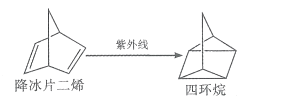
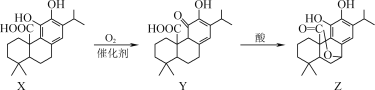
��Ŀ����
����Ŀ�������Ǽס��ҡ�����λͬѧ��ȡ����������ʵ����̣������������⡣
��ʵ��Ŀ�ģ���ȡ��������
��ʵ��ԭ�����ס��ҡ�����λͬѧ�������Ҵ���������Ũ�����Ϲ��ȵķ�����ȡ��������
��װ����ƣ��ס��ҡ�����λͬѧ�ֱ��������������ʵ��װ�ã�

��Ӽס�����λͬѧ��Ƶ�װ����ѡ��һ����Ϊʵ������ȡ����������װ�ã��Ϻ�������________������������������������ͬѧ����װ�ý����˸Ľ��������еIJ������ܸij������θ���ܣ��������������⣬��һ��Ҫ������________________��
��ʵ�鲽�裩
��1������ѡ���װ����װ���������Թ����ȼ���3mL�Ҵ�������ҡ���»�������2mLŨ���ᣬ���ҡ�ȣ���ȴ���ټ���2mL�����ᣬ����2��3�����Ƭ��
��2�����Թ̶ܹ�������̨�ϣ�
��3�����Թ����м��������ı���Na2CO3��Һ��
��4���þƾ��ƶ��Թ������ȣ�
��5�����۲쵽�Թ���������������ʱֹͣʵ�顣
���������ۣ�
a�����裨1����װʵ��װ�ã�����ҩƷǰ��Ӧ���________��
b��д���Թ����з�����Ӧ�Ļ�ѧ����ʽ��ע����Ӧ��������________________��
c���Թ����б���Na2CO3��Һ��������________________��
d�����Թ����з��������������ʵ�������________________��
���𰸡��� ��ֹ���� װ�õ������� CH3COOH��C2H5OH![]() CH3COOCH2CH3��H2O �����Ҵ�����ȥ���ή�������������ܽ�ȣ�ʹ��ֲ� ��Һ
CH3COOCH2CH3��H2O �����Ҵ�����ȥ���ή�������������ܽ�ȣ�ʹ��ֲ� ��Һ
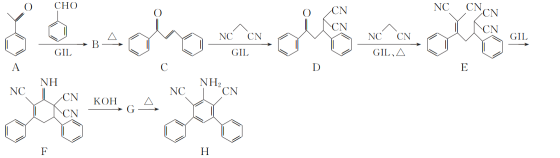
��������
������Ҵ���Ũ���������·���������Ӧ����������������ˮ��������Ҵ�������ˮ��������Һ������Ϊ�˷�ֹ���������θ���ܵ�����ͬʱҲ���������á�����Na2CO3��Һ�е�ˮ�ܽ��Ҵ����ܸ����ᷴӦ�������ᣬ�����ŵ�������������ζ�����������������ڱ���̼������Һ��
�Ϻ��������ң���Ϊ������Ҵ�������ˮ�����ܲ��ܲ���Һ�����£��������������������ܸij����θ���ܣ����������������ã�
a������ʵ��ǰ����Ҫ���װ�õ������ԣ�
b����������Ӧ�У�������ȥ�ǻ����Ҵ���ȥ�ǻ��е�H��ԭ�ӣ�Ũ���������������ȣ���Ϊ���淴Ӧ����ѧ����ʽΪCH3COOH��C2H5OH![]() CH3COOCH2CH3��H2O��
CH3COOCH2CH3��H2O��
c��ʵ������У��Ҵ��������ӷ��������Ҵ�������Na2CO3��Һ���������Na2CO3��Ӧ����������������Na2CO3��Һ�������������������Na2CO3��Һ�������������Ҵ�����ȥ���ᣬ���������������ܽ�ȣ�ʹ��ֲ㣻
d��������������������Na2CO3��Һ�����õ������ֻ������ܵ�Һ�壬���뻥�����ܵ�Һ�壬�÷�Һ��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ���Т��ĸ������Ϊ0.5 L�ĺ����ܱ��������ڢ��а���ͬͶ�ϱ�(Z)����HCl��O2(���±�)���������������Ӧ4HCl(g)��O2(g)![]() 2Cl2(g)��2H2O(g)����H��HCl��ƽ��ת����(��)��Z���¶�(t)�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
2Cl2(g)��2H2O(g)����H��HCl��ƽ��ת����(��)��Z���¶�(t)�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
���� | ��ʼʱ | ||
t/�� | n(HCl)/mol | Z | |
�� | 300 | 0.25 | a |
�� | 300 | 0.25 | b |
�� | 300 | 0.25 | 4 |
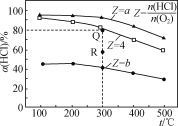
A. ��H<0��a<4<b
B. 300��÷�Ӧ��ƽ�ⳣ����ֵΪ64
C. ������ijʱ�̴���R�㣬��R�������>������ѹǿ��p(R)>p(Q)
D. ����ʼʱ�����������г���0.25molCl2��0.25molH2O(g)��300���ƽ��ʱ������c(HCl)��0.1mol��L��1
����Ŀ��M��N��X��Y��������Ԫ�������ڱ�������λ������ͼ��ʾ����֪���ǵ�ԭ�������ܺ�Ϊ46��

(1)M��Y�γɵĻ������к�________������__________���ӡ�(����ԡ��Ǽ��ԡ�)
(2)NԪ���γɵĵ��ʷ����еĻ�ѧ�����ͼ���Ŀ��__________________(��Ҽ����м���)���ڻ�ѧ��Ӧ��________���ѡ�
(3)��N��Y���⻯������������ɵ����ʵĵ���ʽΪ_________________�����еĻ�ѧ����__________________________��
(4)д��M������XԪ������������Ӧ��ˮ���ﷴӦ�Ļ�ѧ����ʽ_____________��
(5)�˵������XԪ����8��Ԫ�ؿ��γɶ������ӣ���Ҫ������ո��У�
������ | 16 | 16 | 16 |
������ | 16 | 17 | 18 |
��ѧʽ | _______ | ________ | ________ |
����Ŀ������±��ش�������������Ϊ�����µ���������
�� | ���볣��(Ka) | �� | ���볣��(Ka) | �� | ���볣��(Ka) | �� | ���볣��(Ka) |
CH3COOH | 1.8��10-5 | H2CO3 | K1=4.4��10-7 K2=4.7��10-11 | H2C2O 4 | K1=5.4��10-2 K2=5.4��10-5 | H2S | K1=1.3��10-7 K2=7.1��10-15 |
HClO | 3��10-8 |
��ش��������⣺
��1��ͬŨ�ȵ�CH3COO-��HCO3-��CO32-��HC2O4-��ClO-��S2-�н��H+��������������__________��
��2��������0.1 molL-1��CH3COOH��Һ�ڼ�ˮϡ�����У����б���ʽ������һ����С����_______�����������
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
��3��0.1 molL-1��H2C2O4��Һ��0.1 molL-1��KOH����Һ�������Ϻ�������Һ�����ԣ�����Һ�и�����Ũ���ɴ�С��˳��Ϊ______________��
��4��pH��ͬ��NaClO��CH3COOK��Һ������Һ�����ʵ���Ũ�ȵĴ�С��ϵ�ǣ�CH3COONa______NaClO������Һ�У�[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)]���������������=������
��5����0.1 molL-1CH3COOH ��Һ�еμ� NaOH ��Һ�� c(CH3COOH): c(CH3COO-)=5 : 9����ʱ��ҺpH=_______________��