题目内容
化学实验是实现科学探究的重要途径。请将下列有关实验的问题填写完整。
(1)下图是探究氯气性质的部分实验装置。实验室可用浓盐酸与二氧化锰共热来制取氯气,同时生成二氯化猛(MnC12)和水,该反应的化学方程式为 ;实验时,A装置中的KI淀粉试纸变蓝色,其原因是 ;B装置中可观察到的现象是 ;C装置中NaOH溶液的作用是 ,有关反应的离子方程式为 。

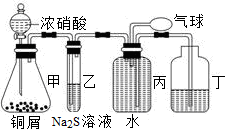
(2)某研究性学习小组的同学用以下仪器组合的装置制取氨气,并探究氨气与氧化铜反应的性
质(已知:2NH3+3CuO

请从上图中选用所需的仪器组成一套装置制取氨气,并使氨气与氧化铜反应,同时证明该反应有水生成。下表是按仪器的连接顺序由上至下依次填写的,请将该表补充填写完整。
(1)下图是探究氯气性质的部分实验装置。实验室可用浓盐酸与二氧化锰共热来制取氯气,同时生成二氯化猛(MnC12)和水,该反应的化学方程式为 ;实验时,A装置中的KI淀粉试纸变蓝色,其原因是 ;B装置中可观察到的现象是 ;C装置中NaOH溶液的作用是 ,有关反应的离子方程式为 。

(2)某研究性学习小组的同学用以下仪器组合的装置制取氨气,并探究氨气与氧化铜反应的性
质(已知:2NH3+3CuO


请从上图中选用所需的仪器组成一套装置制取氨气,并使氨气与氧化铜反应,同时证明该反应有水生成。下表是按仪器的连接顺序由上至下依次填写的,请将该表补充填写完整。
| 选用的仪器(填字母) | 加入的试剂 | 作用 |
| | | 反应器(或发生气体) |
| C | | |
| | 氧化铜 | 使氨气与氧化铜反应 |
| | | |
(1)MnO2+4HCl(浓)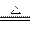 MnCl2+Cl2↑+2H2O(2分) Cl2置换出I2,I2遇淀粉变蓝色(1分) 湿润的有色布条褪色(1分) 吸收多余的氯气,防止污染空气(1分) Cl2+2OH-==Cl-+ClO-+H2O (2分)
MnCl2+Cl2↑+2H2O(2分) Cl2置换出I2,I2遇淀粉变蓝色(1分) 湿润的有色布条褪色(1分) 吸收多余的氯气,防止污染空气(1分) Cl2+2OH-==Cl-+ClO-+H2O (2分)
(2)(每空1分,共8分)
(合理答案均可)
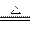 MnCl2+Cl2↑+2H2O(2分) Cl2置换出I2,I2遇淀粉变蓝色(1分) 湿润的有色布条褪色(1分) 吸收多余的氯气,防止污染空气(1分) Cl2+2OH-==Cl-+ClO-+H2O (2分)
MnCl2+Cl2↑+2H2O(2分) Cl2置换出I2,I2遇淀粉变蓝色(1分) 湿润的有色布条褪色(1分) 吸收多余的氯气,防止污染空气(1分) Cl2+2OH-==Cl-+ClO-+H2O (2分) (2)(每空1分,共8分)
选用的仪器 (填字母) (填字母) | 加入的试剂 | 作用 |
| A | 氯化铵和氢氧化钙 | |
| | 碱石灰(或氧化钙) | 干燥氨气 |
| B | | |
| D | 无水硫酸铜 | 检验生成的水 |
略

练习册系列答案
相关题目

 __ (填写字母编号,有几个写几个,多写或写错0分)。
__ (填写字母编号,有几个写几个,多写或写错0分)。 了钝化,若铁棒表面________,则铁和浓硫酸未发生反应。
了钝化,若铁棒表面________,则铁和浓硫酸未发生反应。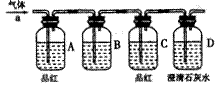
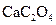 为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作:
为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作: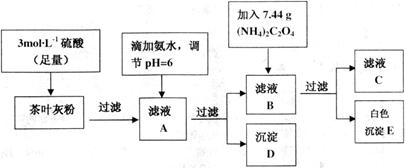
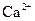
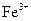
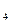 标准溶液滴定C溶液时所发生的反应为:
标准溶液滴定C溶液时所发生的反应为: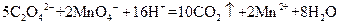 。
。
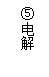
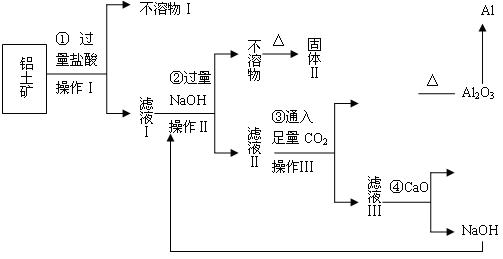
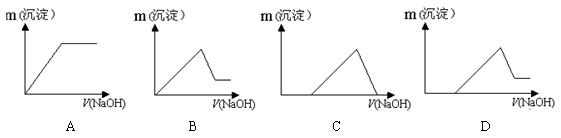
 发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。 提供的试剂,设计出一种
提供的试剂,设计出一种 方案进行了实
方案进行了实 验,并通过观察现象,得出乙同学的观点正确。
验,并通过观察现象,得出乙同学的观点正确。
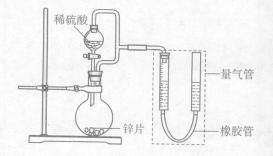
 。
。