题目内容
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。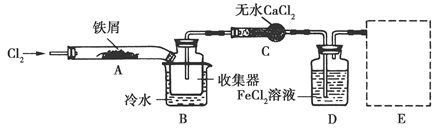
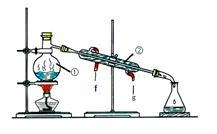
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为______________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)________。
(4)装置B中冷水浴的作用为________;装置C的名称为________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:________。
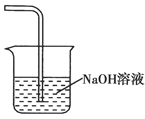
(5)在虚线框中画出尾气吸收装置E并注明试剂。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为________________。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为____________________。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;②________________。
(1)2Fe+3Cl2 2FeCl3
2FeCl3
(2)在沉积的FeCl3固体下方加热
(3)②⑤
(4)冷却,使FeCl3沉积,便于收集产品 干燥管
K3[Fe(CN)6]溶液
(5)
(6)2Fe3++H2S=2Fe2++S↓+2H+
(7)Fe2+-e-=Fe3+
(8)FeCl3得到循环利用
解析

酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000mol?L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的化学方程式为 。
(2)滴定过程中操作滴定管的图示正确的是 。
(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度
(填“偏高”、“偏低”、或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1 。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
| 实验编号 | 温度(℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | 实验目的 a. 实验1和2探究 ; b. 实验1和3探究反应物浓度对该反应速率的影响; c. 实验1和4探究催化剂对该反应速率的影响。 | |
| 体积 (mL) | 浓度 (mol?L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
(4)写出表中a 对应的实验目的 ;若50°C时,草酸浓度c(H2C2O4)随反应时间t的变化曲线 如下图所示,保持其他条件不变,请在图中画出25°C时c(H2C2O4)随t的变化曲线示意图。

(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
(6)该实验中使用的催化剂应选择MnSO4而不是MnCl2,原因可用离子方程式表示为 。
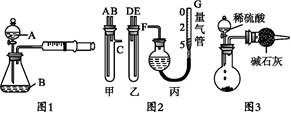
(12分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如下:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
V.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是______________________。
(2)棉花中浸润的溶液为__________________。
(3)A中发生反应的化学方程式为__________________________________。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是______________
(5)过程Ⅵ中检验B溶液中是否含有硫酸根的操作是________________________________
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是
| | 过程IV B溶液中含有的离子 | 过程VI B溶液中含有的离子 |
| 甲 | 有Fe3+无Fe2+ | 有SO42﹣ |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
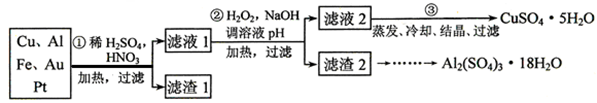
为探索工业废料的再利用,某化学兴趣小组设计了如下左图实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。 
请回答:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 ,该操作中除用到烧杯和玻璃棒外,还必须用到的玻璃仪器有 。
(2)试剂X是
(3)步骤Ⅱ中发生反应的离子方程式是:_______________________________________
(4)进行步骤Ⅱ时,该小组用如上右图所示装置及试剂将制得的CO2气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,为了避免固体C减少,改进的措施是在装置Ⅰ、Ⅱ之间增加一个 ________________________________________。
(5)溶液D中各离子的浓度由大到小的顺序为:__________________________________
(6)工业上由X和F制得CuSO4,还必须使用的最恰当的试剂可以是_____或_________。
| A.浓H2SO4 | B.Fe2O3 | C.HNO3 | D.O2 E.H2O2 |