题目内容
【题目】下列是元素周期表的一部分,回答下列有关问题:
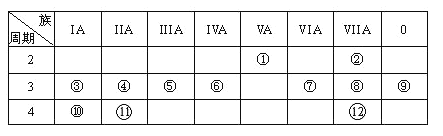
(1)写出元素⑥的元素符号:__________,元素⑦离子的电子式__________。
(2)画出元素④的原子结构示意图:________________________。
(3)在这些元素中,最不活泼的元素是__________(写元素符号)。
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是___________,碱性最强的是_____________,呈两性的氢氧化物是_______________。(以上均要求写化学式)
(5)推测50号元素在周期表中的位置:_________________________________。
(6)元素周期表中,元素性质与它们所形成的单质和化合物的性质均有周期性变化规律,试写出一条第三周期元素所形成的化合物某种性质的变化规律:__________________________。
【答案】Si ![]()
 Ar HClO4 KOH Al(OH)3 第五周期 IV A族 随着原子序数的递增,氢化物的稳定性减弱;随着原子序数的递增,最高价氧化物对应的水化物的碱性减弱,酸性增强。
Ar HClO4 KOH Al(OH)3 第五周期 IV A族 随着原子序数的递增,氢化物的稳定性减弱;随着原子序数的递增,最高价氧化物对应的水化物的碱性减弱,酸性增强。
【解析】
由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K,为Ca,为Br,然后利用元素及其单质、化合物的性质来解答。
(1)由上述分析可知⑥Si,⑦S,硫离子的电子式为![]() ;
;
(2)④为Mg,原子结构示意图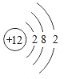 ;
;
(3)以上元素中Ar的最外层电子数为8,稳定结构,则Ar最不活泼;
(4)非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性最强的是F,次之为Cl,但F物最高价氧化物,则在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4;金属性越强,最高价氧化物对应水化物的碱性越强,金属性最强的是K,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(5)50号元素核外电子排布示意图为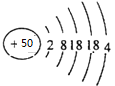 ,电子层数等于周期数,最外层电子数等于主族序数,在周期表中的位置第五周期 IV A族;
,电子层数等于周期数,最外层电子数等于主族序数,在周期表中的位置第五周期 IV A族;
(6)元素周期表中,元素性质与它们所形成的单质和化合物的性质均有周期性变化规律,随着原子序数的递增,氢化物的稳定性减弱;随着原子序数的递增,最高价氧化物对应的水化物的碱性减弱,酸性增强。