题目内容
【题目】工业制得的纯碱中往往含有少量的NaCl固体,现设计以下两种方案测定样品中纯碱的纯度。完成下列填空:
方案一:测量装置如图所示,称取样品m克装入Y型试管中。
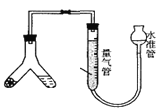
(1)检查装置气密性的方法是__________。
(2)量气管中的液体应为__________(填编号)。
a 饱和Na2CO3溶液 b 饱和NaHCO3溶液 c 饱和NaCl溶液
(3)Y型试管另一端应装入试剂为__________(填编号)。
a 盐酸 b 硫酸 c 硝酸
方案二:装置如图二所示,A中样品质量为m克。
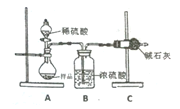
(4)根据图中所用实验装置,可以判断需要测定的实验数据是__________。
(5)仔细分析该装置,由此测的的数据计算出的实验结果有可能偏高也有可能偏低,分析原因并对装置进行相应的改进(已知:装置气密性良好);
(i)偏低的原因是____________,改进方法是__________。
(ii)偏高的原因是_____________,改进方法是_________。
【答案】上提水准管,使左右两边形成液面差,一段时间内液面差不变,则气密性良好 b b C装置反应前后的质量 CO2未全部被吸收 通入氮气,使CO2全部进入C装置中 空气中的CO2和H2O进入C装置中 在C装置后再接一个干燥装置
【解析】
方案一、该实验设计的原理为通过纯碱样品与没有挥发性的硫酸反应生成二氧化碳,用饱和碳酸氢钠溶液测定反应生成的二氧化碳的体积,达到测定样品中纯碱的纯度的目的;
方案二、该实验设计的原理为纯碱样品与稀硫酸反应生成二氧化碳,用浓硫酸干燥二氧化碳,用碱石灰吸收反应生成的二氧化碳,通过测定干燥管前后质量的变化,达到测定样品中纯碱的纯度的目的。
(1)检查装置气密性,可上提右边的水准管,使水准管和量气管两边形成液面差,若装置气密性良好,一段时间内液面差不变,否则漏气,故答案为:上提水准管,使左右两边形成液面差,一段时间内液面差不变,则气密性良好;
(2)纯碱与酸反应生成二氧化碳,二氧化碳能溶于水,用饱和碳酸氢钠溶液可以降低二氧化碳的溶解度,减小实验误差,故答案为:b;
(3)盐酸和硝酸具有挥发性,挥发出的氯化氢和硝酸能与碳酸氢钠溶液反应生成二氧化碳,使所测结果偏高,则Y型试管另一端应装入没有挥发性的硫酸,减小实验误差,故答案为:b;
(4)由图可知,该实验设计的原理为通过测定干燥管前后质量的变化,达到测定样品中纯碱的纯度的目的,故答案为:C装置反应前后的质量;
(5)(i)根据实验原理,保证纯碱样品与稀硫酸反应产生的二氧化碳被碱石灰完全吸收是实验的关键,若反应生成的二氧化碳没有被完全吸收,会导致所测结果偏低,为减小实验误差,应在纯碱样品与稀硫酸完全反应后,通入氮气使反应生成的二氧化碳被碱石灰完全吸收,故答案为:CO2未全部被吸收;通入氮气,使CO2全部进入C装置中;
(ii)碱石灰能够吸收空气中的二氧化碳和水,导致所测结果偏高,为减小实验误差,应在在C装置后再接一个盛有碱石灰的干燥装置,吸收空气中的二氧化碳和水,故答案为:空气中的CO2和H2O进入C装置中;在C装置后再接一个干燥装置。

 智能训练练测考系列答案
智能训练练测考系列答案【题目】正丁醚是一种用途很广的化工产品,毒性和危险性小,是安全性很高的有机溶剂,对许多天然及合成油脂、树脂、橡胶、有机酸酯、生物碱等都有很强的溶解能力,还可作为电子级清洗剂和多种有机合成材料。可通过以下反应原理制取正丁醚:
2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
己知相关物质的部分信息如下:
沸点(℃) | 密度(g/cm3) | 溶解度(g) | 相对分子质量 | |
正丁醇 | 117.7 | 0.81 | 7.9 | 74 |
正丁醚 | 142 | 0.77 | 不溶于水 | 130 |
某课外化学学习小组查阅相关资料设计了以下实验步骤合成正丁醚:
①在100 mL两口烧瓶中加入30.0 mL正丁醇、5.0 mL浓硫酸和几粒沸石,充分摇匀。在分水器中加入3.0 mL饱和食盐水,按图甲组装仪器,接通冷凝水;
②反应:在电热套上加热,使瓶内液体微沸,回流反应约1小时。当馏液充满分水器时,打开分水器放出一部分水。当水层不再变化,瓶中反应温度达150 ℃,反应己基本完成,停止加热;
③蒸馏:待反应液冷却后,拆下分水器,将仪器改成蒸馏装置如图丙,再加几粒沸石,蒸馏,收集馏分;
④精制:将馏出液倒入盛有10 mL水的分液漏斗中,充分振摇,静置弃去水液,有机层依次用5 mL水,3 mL 5% NaOH溶液、3 mL水和3 mL饱和氯化钙溶液洗涤,分去水层,将产物放入洁净干燥的小锥形瓶中,然后加入0.2~0.4 9无水氯化钙,再将液体转入装置丙中进行蒸馏,收集到馏分9.0 mL。
甲. 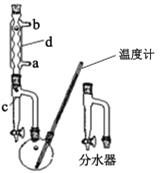 乙.
乙. ![]() 丙.
丙.
请根据以上操作回答下列问题:
(1)制备正丁醚的反应类型是___,仪器d的名称是____。
(2)在步骤①中添加试剂的顺序是____。相比装置乙,装置甲的优点是 ___。
(3)在步骤②中采用电热套加热而不采用酒精灯直接加热的原因可能是____。
(4)在步骤③中收集馏分适宜的温度范围为____(填正确答案标号)。
A.115℃~ll9℃ B.140℃~144℃ C. 148℃~152℃
(5)在精制中,有机层在____层(填“上”或“下”),加入无水氯化钙的作用是____。
(6)本小组实验后所得正丁醚的产率约为 ___%(计算结果保留一位小数)。