题目内容
【题目】某研究小组为了探究一种浅绿色盐X(仅含四种元素,不含结晶水,M(X)<908gmol-1)的组成和性质,设计并完成了如下实验:
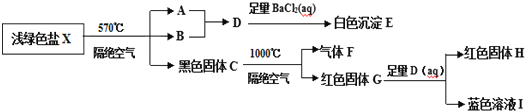
取一定量的浅绿色盐X进行上述实验,充分反应后得到23.3g白色沉淀E、28.8g红色固体G和12.8g红色固体H。
已知:①浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应;
②常温下B呈液态且1个B分子含有10个电子。
请回答如下问题:
(1)写出B分子的电子式___。
(2)已知G溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的离子方程式为___。
(3)在隔绝空气、570℃温度下加热X至完全分解的化学反应方程式为___。
(4)一定条件下,NH3与黑色固体C发生氧化还原反应得到红色固体和气体丙(丙是大气主要成分之一),写出一个可能的化学反应方程式___。
【答案】![]() 3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O Cu4(OH)6SO4
3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O Cu4(OH)6SO4![]() 4CuO+SO3↑+3H2O↑ 3CuO+2NH3
4CuO+SO3↑+3H2O↑ 3CuO+2NH3![]() N2+3Cu2O+3H2O
N2+3Cu2O+3H2O
【解析】
浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应,得到A、B和黑色固体C,常温下B呈液态,且1个B分子含有10个电子,B为水;A和水反应生成的D能和氯化钡反应生成白色沉淀E,E只能为硫酸钡,则A为SO3,D为H2SO4;黑色固体C可能为四氧化三铁、氧化铜、碳等,黑色固体C隔绝空气在1000℃反应生成气体F和红色固体G,G能和硫酸反应生成红色固体和蓝色溶液应为氧化亚铜在酸性溶液中的歧化反应,Cu2O+H2SO4=CuSO4+Cu+H2O,所以红色固体G为氧化亚铜,气体F为氧气,红色固体H为铜,蓝色溶液I为硫酸铜,黑色固体C为氧化铜,据此分析解答。
(1)B为水,水是共价化合物,氢原子和氧原子之间以共价键结合,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)红色固体G为氧化亚铜,Cu2O中+1价的铜被硝酸氧化,稀硝酸被还原成一氧化氮,反应的离子方程式为:3Cu2O+14H++2NO3-═6Cu2++2NO↑+7H2O,故答案为:3Cu2O+14H++2NO3-═6Cu2++2NO↑+7H2O;
(3)根据上述分析,A为SO3, B为水,C为氧化铜,D为H2SO4,E为硫酸钡,F为氧气,G为氧化亚铜,H为铜,I为硫酸铜。23.3g白色沉淀E(硫酸钡)的物质的量为n=![]() =0.1mol,浅绿色盐X中n(Cu)=0.4mol,n(S)=0.1mol,n(CuO)∶n(SO3)=1∶4,仅含四种元素,不含结晶水,设化学式为:Cu4(OH)mSO4,Cu4(OH)mSO4
=0.1mol,浅绿色盐X中n(Cu)=0.4mol,n(S)=0.1mol,n(CuO)∶n(SO3)=1∶4,仅含四种元素,不含结晶水,设化学式为:Cu4(OH)mSO4,Cu4(OH)mSO4 ![]() 4CuO+SO3↑+
4CuO+SO3↑+![]() H2O↑,根据氧元素守恒得:m=6,符合M(X)<908gmol-1,则该反应流程为:X在隔绝空气、570℃温度下加热Cu4(OH)6SO4
H2O↑,根据氧元素守恒得:m=6,符合M(X)<908gmol-1,则该反应流程为:X在隔绝空气、570℃温度下加热Cu4(OH)6SO4 ![]() 4CuO+SO3↑+3H2O↑,故答案为:Cu4(OH)6SO4
4CuO+SO3↑+3H2O↑,故答案为:Cu4(OH)6SO4 ![]() 4CuO+SO3↑+3H2O↑;
4CuO+SO3↑+3H2O↑;
(4)空气的主要成分为氧气、氮气,黑色固体C为氧化铜,与氨气反应生成氮气,气体丙为氮气、铜(0价)或氧化亚铜(铜为+1价)和水,红色固体为铜或氧化亚铜,反应的化学方程式可能为:3CuO+2NH3 ![]() N2+3Cu+3H2O或3CuO+2NH3
N2+3Cu+3H2O或3CuO+2NH3![]() N2+3Cu2O+3H2O,故答案为:3CuO+2NH3
N2+3Cu2O+3H2O,故答案为:3CuO+2NH3 ![]() N2+3Cu+3H2O或3CuO+2NH3
N2+3Cu+3H2O或3CuO+2NH3![]() N2+3Cu2O+3H2O。
N2+3Cu2O+3H2O。