题目内容
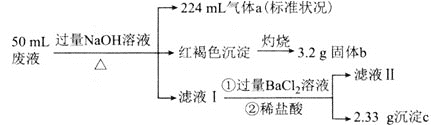
【题目】某稀硫酸和稀硝酸的混合溶液![]() ,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解
,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解![]() 。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示
。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示![]() 已知硝酸只被还原为NO气体
已知硝酸只被还原为NO气体![]() 。下列分析或结果错误的是
。下列分析或结果错误的是

A.原混合酸中![]() 的物质的量为
的物质的量为![]()
B.OA段产生的是NO,AB段发生的反应为![]() ,BC段产生氢气
,BC段产生氢气
C.第二份溶液中最终溶质为![]()
D.![]() 浓度为
浓度为![]()
【答案】A
【解析】
由图象可知,由于铁过量,OA段发生反应为:![]() ,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑。
,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑。
A、OA段发生反应为:![]() ,硝酸全部起氧化剂作用,根据铁的物质的量结合离子方程式计算;
,硝酸全部起氧化剂作用,根据铁的物质的量结合离子方程式计算;
B、铁先与硝酸反应生成一氧化氮与铁离子,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应;
C、铁先与硝酸反应,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应,铁单质全部转化为亚铁离子,硝酸全部起氧化剂作用,没有显酸性的硝酸;
D、根据铁和硫酸的反应中铁的质量来确定所需硫酸的量,进而确定硫酸的浓度。
A、根据题图可知,OA段发生的反应为:![]() ,硝酸全部起氧化剂作用,所以每份混合酸中
,硝酸全部起氧化剂作用,所以每份混合酸中![]() ,所以原混合酸中
,所以原混合酸中![]() 的物质的量为
的物质的量为![]() ,A符合题意;
,A符合题意;
B、OA段发生的反应为:![]() ,产生NO,AB段发生的反应为
,产生NO,AB段发生的反应为![]() ,BC段发生的反应为
,BC段发生的反应为![]() ,产生氢气,B不符合题意;
,产生氢气,B不符合题意;
C、第二份溶液中硝酸全部被还原,因为溶液中有![]() ,并且Fe全部转化为
,并且Fe全部转化为![]() ,所以最终溶液中溶质为
,所以最终溶液中溶质为![]() ,C不符合题意;
,C不符合题意;
D、反应最终消耗![]() ,其物质的量为
,其物质的量为![]() ,所有的铁都以硫酸亚铁的形式存在于溶液中,根据
,所有的铁都以硫酸亚铁的形式存在于溶液中,根据![]() 守恒可知,每份溶液中含硫酸
守恒可知,每份溶液中含硫酸![]() ,所以硫酸的浓度是
,所以硫酸的浓度是![]() ,D不符合题意;
,D不符合题意;
故答案为:A。

练习册系列答案
相关题目