��Ŀ����
����Ŀ����2.0 L�����ܱ������г���1.0 mol PCl5�����¶�ΪT��ʱ�������·�ӦPCl5(g) ![]() PCl3(g)+C12(g) ��H��+124 kJ��mol��1����Ӧ�����вⶨ�IJ������ݼ��±���
PCl3(g)+C12(g) ��H��+124 kJ��mol��1����Ӧ�����вⶨ�IJ������ݼ��±���
ʱ��t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3��/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
�ش�����������
��1����Ӧ��ǰ50 s��ƽ������v(PCl5) �� ��
��2���¶�ΪT��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ���� ��
��3��Ҫ���������Ӧ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� (��дһ��)��
��4�����¶�ΪT��ʱ������ʼʱ����0.5 mol PCl5��a mol Cl2��ƽ��ʱPCl5��ת������Ϊ20������
a�� ��
���𰸡���1��0.0016 mol/( L��s)����2��0.025����3�������¶�������ѹǿ������PCl3��Cl2������4��0.1��
��������
�����������1������PCl5�����ʵ���Ϊ0.16mol�����ݻ�ѧ��Ӧ���ʵı���ʽ��v(PCl5)=0.16/(2��50)mol/( L��s)=0.0016mol/( L��s)����2������ƽ�ⳣ���ı���ʽ��K=c(PCl3)��c(Cl2)/c(PCl5)=0.1��0.1/0.4=0.025����3�����PCl5��ת���ʣ���ʹ��Ӧ������Ӧ������У���˴�ʩ�������¶ȡ�����ѹǿ������PCl3�ȣ�
��4��PCl5(g)![]() PCl3(g)+C12(g)
PCl3(g)+C12(g)
��ʼ�� 0.5 0 a
�仯�� 0.5��20% 0.1 a��0.1
ƽ�⣺ 0.4 0.1 a��0.1
��ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬������ֵ��K=0.025�����a=0.1��

 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�����Ŀ��ͭ���仯�����ڹ�ũҵ�������ճ�������Ӧ�÷dz��㷺���ش��������⣺
��1������Cu2O���ھ��������Ĵ����ܶ��ܵ���ע����ȡCu2O�����ַ������±���ʾ��
����I | ��̿���ڸ��������»�ԭCuO����Cu2O��CO2 |
����II | ����(N2H4)��ԭ����Cu(OH)2 |
�� ����I�л�ԭ���������������ʵ���֮��Ϊ________��
�� ����II������Ӧ�Ļ�ѧ����ʽΪ______________��
��2���⻯��ͭ��һ�ֺ�ɫͬ�壬�������з�Ӧ�Ʊ���
4CuSO4+3H3PO2+6H2O=4CuH��+4H2SO4+3H3PO4
�÷�Ӧ��ÿת��3 mol���ӣ�����CuH�����ʵ���Ϊ___________mol��
��3���Ȼ�ͭ��Һ�и��ֺ�ͭ���ķֲ�����(ƽ��ʱij����Ũ��ռ����Ũ��֮�͵ķ���)��c(C1-)֮��Ĺ�ϵ��ͼ��ʾ��
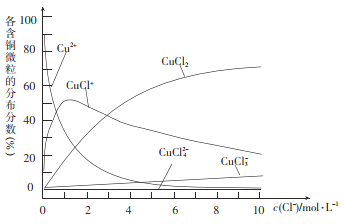
�� ��c(C1-)= 9 mol/Lʱ����Һ��3����Ҫ��ͭ��Ũ�ȵĴ�С��ϵΪ__________��
�� ��c(C1-)= l mol /L���Ȼ�ͭ��Һ�У�����AgNO3��Һ��CuCl+ת��ΪCu2+�����ӷ���ʽΪ____________��
��4����֪:Cu(OH)2�Ƕ�Ԫ����,25��ʱKsp[Cu(OH)2]=2.0��10-20������¶�����ͭ����Һ��Cu2+����ˮ�ⷴӦ��ƽ�ⳣ��Ϊ______________��