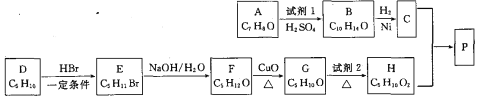
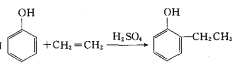题目内容
【题目】现有反应:CO(g)+ H2O(g)![]() CO2(g)+ H2(g) △H﹤0,在850℃时,平衡常数K=1。现在850℃时,向2L的密闭容器中充入CO、H2O(g)各4mol,试回答下列问题(写出具体的计算过程):
CO2(g)+ H2(g) △H﹤0,在850℃时,平衡常数K=1。现在850℃时,向2L的密闭容器中充入CO、H2O(g)各4mol,试回答下列问题(写出具体的计算过程):
(1)达平衡时,CO转化率为多少?
(2)H2的体积分数为多少?
(3)若温度仍为850℃,初始时CO浓度为2mol/L,H2O(g)为6mol/L,则平衡时CO转化率为多少?
【答案】(1)50﹪;(2)25﹪;(3)75﹪ 。
【解析】试题分析: CO(g)+ H2O(g)![]() CO2(g)+ H2(g)
CO2(g)+ H2(g)
起始浓度(mol/L) 2 2 0 0
转化浓度(mol/L) x x x x
平衡浓度(mol/L) 2-x 2-x x x
根据平衡常数可知(2-x)×(2-x)/x×x=1
解得x=1
(1)达平衡时,CO转化率为![]() ×100%=50%;
×100%=50%;
(2)H2的体积分数为![]() ×100%=25%;
×100%=25%;
(3) CO(g)+ H2O(g)![]() CO2(g)+ H2(g)
CO2(g)+ H2(g)
起始浓度(mol/L) 2 6 0 0
转化浓度(mol/L) y y y y
平衡浓度(mol/L) 2-y 6-y y y
根据平衡常数可知(2-y)×(6-y)/y×y=1
解得x=1.5
所以达平衡时,CO转化率为![]() ×100%=75%
×100%=75%

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、F在元素周期表中的相对位置 如图,B与氧元素能形成两种无色气体,D是地壳中含量最多的元素,E是地壳中含量最多的金属元素。
B | ||
F |
(1)BF2的结构式为____________。
(2)D和 F氢化物中沸点较高的___________________填化学式)。
(3)工业制取E单质的化学方程式为______________。
(4)在微电子工业中,C的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______________。
(5)火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入 太空,并且产生三种无污染的气体,其化学方程式为____________。
【题目】请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
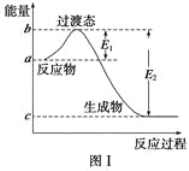
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是 (填“增大”、“减小”或“不变”,下同),ΔH的变化是 。请写出NO2和CO反应的热化学方程式 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)==CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
且H2O(g)==H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为 。
(3)如表所示是部分化学键的键能参数:
化学键 | P—P | P—O | O===O | P===O |
键能/kJ·mol-1 | a | b | c | x |
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x= kJ·mol-1(用含a、b、c、d的代表数式表示)。