题目内容
【题目】铜及其化合物在工农业生产及日常生活中应用非常广泛。回答下列问题:
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,制取Cu2O的两种方法如下表所示。
方法I | 用炭粉在高温条件下还原CuO生成Cu2O和CO2 |
方法II | 用肼(N2H4)还原新制Cu(OH)2 |
① 方法I中还原剂与氧化剂的物质的量之比为________。
② 方法II发生反应的化学方程式为______________。
(2)氢化亚铜是一种红色同体,可由下列反应制备:
4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应中每转移3 mol电子,生成CuH的物质的量为___________mol。
(3)氯化铜溶液中各种含铜微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与c(C1-)之间的关系如图所示。

① 当c(C1-)= 9 mol/L时,溶液中3种主要含铜微粒浓度的大小关系为__________。
② 在c(C1-)= l mol /L的氯化铜溶液中,加人AgNO3溶液,CuCl+转化为Cu2+的离子方程式为____________。
(4)已知:Cu(OH)2是二元弱碱,25℃时Ksp[Cu(OH)2]=2.0×10-20。则此温度下在铜盐溶液中Cu2+发生水解反应的平衡常数为______________。
【答案】(1)①1 : 4②4Cu(OH)2+N2H4=Cu2O+N2↑+6H2O
(2)1
(3)①c(CuC12)>c(CuC1+)>c(CuCl3-)②CuCl+ +Ag+=Cu2+ +AgCl↓
(4)5×10-9
【解析】
试题分析:(1)①用炭粉在高温条件下还原CuO生成Cu2O和CO2,方程式为![]() ,还原剂是C与氧化剂是CuO,物质的量之比为1 : 4;②用肼(N2H4)还原新制Cu(OH)2生成Cu2O、N2、水,发生反应的化学方程式为4Cu(OH)2+N2H4=Cu2O+N2↑+6H2O;(2) 氢化亚铜中铜元素化合价降低1,氢元素化合价降低,2,生成1mol CuH转移3mol电子;(3) ① 根据图像,当c(C1-)= 9 mol/L时,溶液中3种主要含铜微粒浓度的大小关系为c(CuC12)>c(CuC1+)>c(CuCl3-);②CuCl+转化为Cu2+的离子方程式CuCl+ +Ag+=Cu2+ +AgCl↓;
,还原剂是C与氧化剂是CuO,物质的量之比为1 : 4;②用肼(N2H4)还原新制Cu(OH)2生成Cu2O、N2、水,发生反应的化学方程式为4Cu(OH)2+N2H4=Cu2O+N2↑+6H2O;(2) 氢化亚铜中铜元素化合价降低1,氢元素化合价降低,2,生成1mol CuH转移3mol电子;(3) ① 根据图像,当c(C1-)= 9 mol/L时,溶液中3种主要含铜微粒浓度的大小关系为c(CuC12)>c(CuC1+)>c(CuCl3-);②CuCl+转化为Cu2+的离子方程式CuCl+ +Ag+=Cu2+ +AgCl↓;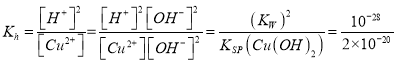 =5×10-9。
=5×10-9。

【题目】下列说法中正确的是
A. 凡是放热反应都是自发的,吸热反应都是非自发的
B. 自发反应一定是熵增大,非自发反应一定是熵减小或不变
C. 自发反应在恰当条件下才能实现
D. 自发反应在任何条件下都能实现
【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、F在元素周期表中的相对位置 如图,B与氧元素能形成两种无色气体,D是地壳中含量最多的元素,E是地壳中含量最多的金属元素。
B | ||
F |
(1)BF2的结构式为____________。
(2)D和 F氢化物中沸点较高的___________________填化学式)。
(3)工业制取E单质的化学方程式为______________。
(4)在微电子工业中,C的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______________。
(5)火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入 太空,并且产生三种无污染的气体,其化学方程式为____________。