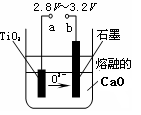
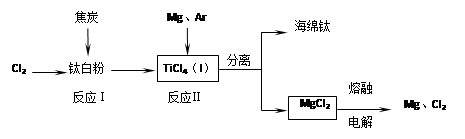题目内容
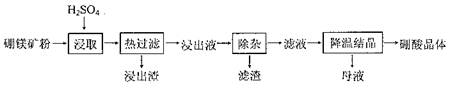
硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2MgO?B2O3?H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如下:
已知:H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g。Fe3 +、Al3+、Fe2 +和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3. 2、5.2、9.7和12.4。
(1)由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器溢出,故应分批加入稀硫酸。该反应的化学方程式为 。
(2)“浸出液”显酸性,含H3BO3和Mg2+、SO42-,还含有Fe3 +、Fe2+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO,除去的杂质离子是 。H2O2的作用是 (用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是 。
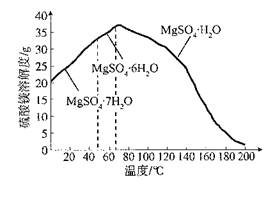
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4?H2O,应采取的措施是将“母液”蒸发浓缩, 。

已知:H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g。Fe3 +、Al3+、Fe2 +和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3. 2、5.2、9.7和12.4。
(1)由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器溢出,故应分批加入稀硫酸。该反应的化学方程式为 。
(2)“浸出液”显酸性,含H3BO3和Mg2+、SO42-,还含有Fe3 +、Fe2+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO,除去的杂质离子是 。H2O2的作用是 (用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是 。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4?H2O,应采取的措施是将“母液”蒸发浓缩, 。

32.(16分)
(1)CaCO3(粉末)+H2SO4=CaSO4+H2O+CO2↑ (3分)
(2)Fe3+、Fe2+、Al3+ (3分,每个1分)
H2O2+2H++2Fe2+=2Fe3++2H2O (3分)
(3)防止温度下降时H3BO3从溶液中析出(意思相同即可给分。例如:从H3BO3溶解度数据可知,温度较高时,H3BO3溶解度较大,不易从溶液中析出。) (3分)
(4)加压升温结晶 (4分,加压、升温结晶各2分)
(1)CaCO3(粉末)+H2SO4=CaSO4+H2O+CO2↑ (3分)
(2)Fe3+、Fe2+、Al3+ (3分,每个1分)
H2O2+2H++2Fe2+=2Fe3++2H2O (3分)
(3)防止温度下降时H3BO3从溶液中析出(意思相同即可给分。例如:从H3BO3溶解度数据可知,温度较高时,H3BO3溶解度较大,不易从溶液中析出。) (3分)
(4)加压升温结晶 (4分,加压、升温结晶各2分)
试题分析:(1)由于硫酸的酸性比碳酸强,则矿粉中的碳酸钙与加入的稀硫酸能发生复分解反应,生成硫酸钙、二氧化碳气体和水,即CaCO3(粉末)+H2SO4=CaSO4+H2O+CO2↑,粉末状碳酸钙及分批加入稀硫酸能加快反应速率、防止微溶的硫酸钙覆盖在碳酸钙固体表面阻止反应的顺利进行;根据流程图及题意可知,浸取时2MgO?B2O3?H2O及少量Fe3O4、CaCO3、Al2O3都能溶于稀硫酸,而SiO2不能溶于稀硫酸;(2)双氧水是常用的绿色氧化剂,所含氧元素由—1价降低为—2价,杂质阳离子中只有亚铁离子能被其氧化为铁离子,即H2O2+2H++2Fe2+=2Fe3++2H2O;由于铁离子和铝离子能够水解,即Fe3++3H2O
 Fe(OH)3+3H+、Al3++3H2O
Fe(OH)3+3H+、Al3++3H2O Al(OH)3+3H+,用稀硫酸浸取及浸出液呈酸性时,能抑制铁离子和铝离子的水解,加入过氧化氢和氧化镁时,能消耗氢离子、生成水且不引入新的杂质阳离子,即MgO+2H+=Mg2++H2O,减小氢离子浓度,增大溶液pH至3.2时,促进铁离子水解到底,即亚铁离子转化为铁离子,铁离子完全沉淀为氢氧化铁,增大溶液pH至5.2时,促进铝离子水街到底,即铝离子完全沉淀为氢氧化铝沉淀,因此加入适量过氧化氢和氧化镁除去的杂质离子是Fe3+、Fe2+、Al3+;(3)浸取时二氧化硅不溶于稀硫酸,浸取反应生成硫酸钙微溶于水,其余物质溶解后变为硼酸、硫酸亚铁、硫酸铁、硫酸镁,根据已知信息,H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g,为了除去固液混合物中的二氧化硅和硫酸钙,且不能损失硼酸,因此应选择硼酸溶解度最大时的温度,进行趁热过滤,防止温度下降时H3BO3从溶液中析出;(4)除杂时,所得滤渣的主要成分是氢氧化铁、氢氧化铝,而母液的主要成分是硼酸、硫酸镁;为了从“母液”中充分回收MgSO4?H2O,根据硫酸镁的溶解度随温度变化的曲线的已知信息推断,若蒸发浓缩、冷却结晶得到的是MgSO4?7H2O晶体,因此应该蒸发浓缩,升温结晶;根据溶液的沸点随压强增大而升高的已知条件,为了防止蒸发时液体沸腾,影响结晶,还要加压结晶,防止蒸发浓缩时溶液沸腾,从而得到MgSO4?H2O晶体。
Al(OH)3+3H+,用稀硫酸浸取及浸出液呈酸性时,能抑制铁离子和铝离子的水解,加入过氧化氢和氧化镁时,能消耗氢离子、生成水且不引入新的杂质阳离子,即MgO+2H+=Mg2++H2O,减小氢离子浓度,增大溶液pH至3.2时,促进铁离子水解到底,即亚铁离子转化为铁离子,铁离子完全沉淀为氢氧化铁,增大溶液pH至5.2时,促进铝离子水街到底,即铝离子完全沉淀为氢氧化铝沉淀,因此加入适量过氧化氢和氧化镁除去的杂质离子是Fe3+、Fe2+、Al3+;(3)浸取时二氧化硅不溶于稀硫酸,浸取反应生成硫酸钙微溶于水,其余物质溶解后变为硼酸、硫酸亚铁、硫酸铁、硫酸镁,根据已知信息,H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g,为了除去固液混合物中的二氧化硅和硫酸钙,且不能损失硼酸,因此应选择硼酸溶解度最大时的温度,进行趁热过滤,防止温度下降时H3BO3从溶液中析出;(4)除杂时,所得滤渣的主要成分是氢氧化铁、氢氧化铝,而母液的主要成分是硼酸、硫酸镁;为了从“母液”中充分回收MgSO4?H2O,根据硫酸镁的溶解度随温度变化的曲线的已知信息推断,若蒸发浓缩、冷却结晶得到的是MgSO4?7H2O晶体,因此应该蒸发浓缩,升温结晶;根据溶液的沸点随压强增大而升高的已知条件,为了防止蒸发时液体沸腾,影响结晶,还要加压结晶,防止蒸发浓缩时溶液沸腾,从而得到MgSO4?H2O晶体。
练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
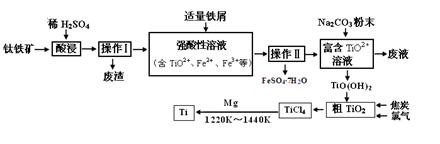



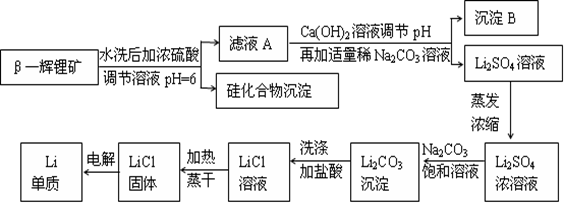
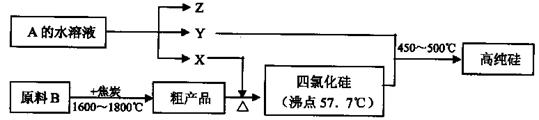

 Al(OH)3+3H+的平衡常数为 (保留两位有效数字);
Al(OH)3+3H+的平衡常数为 (保留两位有效数字); 2Fe+3CO2
2Fe+3CO2 2Hg+O2↑
2Hg+O2↑ 2Mg+O2↑
2Mg+O2↑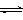 2CrO42- + 2H+
2CrO42- + 2H+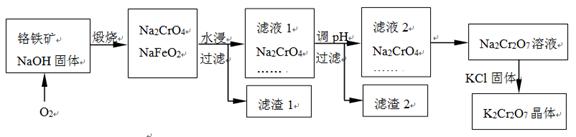 K2Cr2O7中Cr元素的化合价是 。
K2Cr2O7中Cr元素的化合价是 。