题目内容
铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、A12O3、SiO2等)制备铬黄的工艺流程如下:
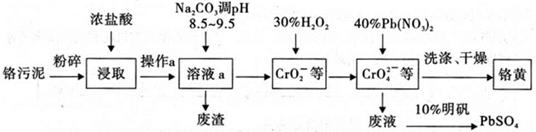
(1)将铬污泥粉碎的目的是 ,操作a的名称为 ;
(2)废渣的主要成分是A1(OH)3和Fe(OH)3。已知25℃时,A1(OH)3的Ksp=1.3×10-33,则该温度下反应Al3++3H2O Al(OH)3+3H+的平衡常数为 (保留两位有效数字);
Al(OH)3+3H+的平衡常数为 (保留两位有效数字);
(3)写出加入30%H2O2过程中发生的离子反应方程式: ;
(4)实验室洗涤铬黄沉淀的方法: ;
(5)写出浓盐酸与A12O3反应的离子方程式: 。

(1)将铬污泥粉碎的目的是 ,操作a的名称为 ;
(2)废渣的主要成分是A1(OH)3和Fe(OH)3。已知25℃时,A1(OH)3的Ksp=1.3×10-33,则该温度下反应Al3++3H2O
 Al(OH)3+3H+的平衡常数为 (保留两位有效数字);
Al(OH)3+3H+的平衡常数为 (保留两位有效数字);(3)写出加入30%H2O2过程中发生的离子反应方程式: ;
(4)实验室洗涤铬黄沉淀的方法: ;
(5)写出浓盐酸与A12O3反应的离子方程式: 。
(14分)(1)增大接触面积,提高浸取率(2分) 过滤(2分)
(2)7.7×10-10(2分)
(3)2CrO2-+3H2O2+2OH-=2CrO42-+4H2O(3分)
(4)加蒸馏水浸没铬黄沉淀,等蒸馏水流尽后,再重复操作1~2次(3分)
(5)Al2O3+6H+=2Al3++3H2O(2分)
(2)7.7×10-10(2分)
(3)2CrO2-+3H2O2+2OH-=2CrO42-+4H2O(3分)
(4)加蒸馏水浸没铬黄沉淀,等蒸馏水流尽后,再重复操作1~2次(3分)
(5)Al2O3+6H+=2Al3++3H2O(2分)
试题分析:(1)铬污泥含有固体反应物,固体粉碎的目的是增大固体反应物的表面积,增大化学反应速率,提高铬等元素的浸取率;氧化铬、氧化铁是碱性氧化物,易溶于过量的浓盐酸,得到含有CrCl3、FeCl3的溶液,氧化铝是两性氧化物,溶于过量的浓盐酸,得到含有AlCl3的溶液,二氧化硅是酸性氧化物,不溶于盐酸,则操作a为过滤,目的是除去SiO2;(2)溶液a中加入适量Na2CO3调pH8.5~9.5时,碳酸根离子与氢离子容易反应生成二氧化碳和水,碳酸根离子与铁离子容易发生双水解反应,生成氢氧化铁沉淀和二氧化碳,碳酸根离子与铝离子容易发生双水解反应,生成氢氧化铝沉淀和二氧化碳,再次过滤所得废渣的主要成分是A1(OH)3和Fe(OH)3,碳酸根离子水解促进铬离子水解,但是铬离子的水解没有进行到底,导致滤液中主要成分是NaCrO2、NaCl等的溶液;由于25℃时H2O
 H++OH-,则Kw=1.0×10-14;由于Al(OH)3(s)
H++OH-,则Kw=1.0×10-14;由于Al(OH)3(s)  Al3++3OH-,则Ksp[Al(OH)3]=c(Al3+)?c3(OH-)=1.3×10-33;由于Al3++3H2O
Al3++3OH-,则Ksp[Al(OH)3]=c(Al3+)?c3(OH-)=1.3×10-33;由于Al3++3H2O Al(OH)3+3H+,则K=
Al(OH)3+3H+,则K=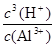 =
=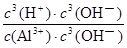 =
=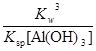 =
= ≈7.7×10-10;
≈7.7×10-10;(3)pH=8.5~9.5时,溶液呈碱性,CrO2-变为CrO42-是氧化反应,铬元素的化合价由+3价升为+6价,由此推断H2O2是该反应的氧化剂,氧元素由—1价降为—2价,则还原产物是水,根据电子、电荷、原子个数守恒原理配平,该过程的离子方程式为2CrO2-+3H2O2+2OH-=2CrO42-+4H2O;(4)洗涤沉淀时,一般是向沉淀中加蒸馏水至浸没铬黄沉淀,等蒸馏水流尽后,再重复操作1~2次;(5)氧化铝是两性氧化物,盐酸是强酸溶液,二者反应生成氯化铝和水,氯化铝是易溶易电离的盐,则该反应为Al2O3+6H+=2Al3++3H2O。

练习册系列答案
相关题目
 2I-+S4O62-)
2I-+S4O62-)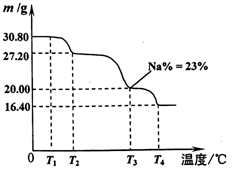

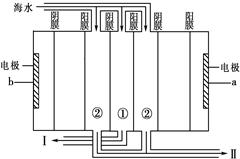
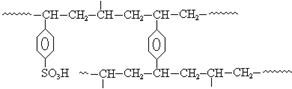
 2H2(g)+S2(g),其平衡常数表达式为K=。
2H2(g)+S2(g),其平衡常数表达式为K=。