题目内容
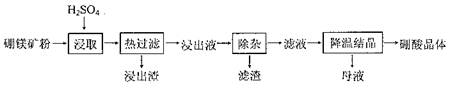
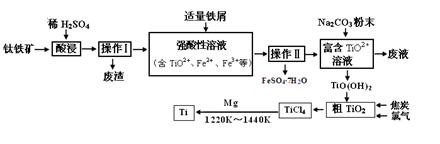
钛合金是航天航空工业的重要材料。由钛铁矿(主要成分为钛酸亚铁,化学式为FeTiO3)制备Ti等产品的一种工艺流程示意图如下:
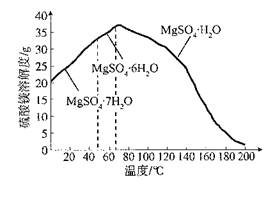
已知:① TiO2+易水解,只能存在于强酸性溶液中。 ②常温下,难溶电解质溶解度与pH关系图。
③25 ℃时TiO(OH)2溶度积Ksp=1×10-29

回答下列问题:
(1)写出钛铁矿酸浸时,反应的离子方程式 。
(2)操作Ⅱ包含的具体操作方法有 。
(3)向“富含TiO2+溶液”中加入Na2CO3粉末的作用是 , TiO2+水解的离子方程式为 ,当溶液pH= 时,TiO(OH)2已沉淀完全。
(4)加入铁屑将Fe3+转化为Fe2+的原因是 。

已知:① TiO2+易水解,只能存在于强酸性溶液中。 ②常温下,难溶电解质溶解度与pH关系图。
③25 ℃时TiO(OH)2溶度积Ksp=1×10-29

回答下列问题:
(1)写出钛铁矿酸浸时,反应的离子方程式 。
(2)操作Ⅱ包含的具体操作方法有 。
(3)向“富含TiO2+溶液”中加入Na2CO3粉末的作用是 , TiO2+水解的离子方程式为 ,当溶液pH= 时,TiO(OH)2已沉淀完全。
(4)加入铁屑将Fe3+转化为Fe2+的原因是 。
(1)FeTiO3+4H+ = TiO2++Fe2++2H2O
(2)蒸发浓缩,冷却结晶,过滤
(3)调节溶液pH,促进TiO2+水解 TiO2++2H2O TiO(OH)2+2H+ 2
TiO(OH)2+2H+ 2
(4)避免使Fe3+和TiO2+共沉淀。
(2)蒸发浓缩,冷却结晶,过滤
(3)调节溶液pH,促进TiO2+水解 TiO2++2H2O
 TiO(OH)2+2H+ 2
TiO(OH)2+2H+ 2(4)避免使Fe3+和TiO2+共沉淀。
试题分析:(1)钛铁矿酸浸时,发生反应的化学方程式为FeTiO3+2H2SO4= TiOSO4+FeSO4+2H2O,其相应的离子方程式FeTiO3+4H+ = TiO2++Fe2++2H2O。(2)向含有TiO2+、Fe2+、Fe3+等的酸性溶液中加入适量的Fe粉,发生反应:2Fe3++Fe=3Fe2+.然后将溶液蒸发浓缩、冷却结晶就会产生FeSO4·7H2O.然后将晶体过滤出来。就得到了绿矾。旅游热中含有大量的TiO2+离子,向该溶液中加入Na2CO3粉末,调整溶液的酸碱性,促进TiO2+水解,发生反应TiO2++2H2O
 TiO(OH)2+2H+。由图像可知当溶液的PH=2时TiO(OH)2已沉淀完全。(4)若不加入Fe粉,就会同时产生TiO(OH)2和Fe(OH)3.导致制取的物质纯度不高。所以加入铁屑将Fe3+转化为Fe2+避免使Fe3+和TiO2+共沉淀。
TiO(OH)2+2H+。由图像可知当溶液的PH=2时TiO(OH)2已沉淀完全。(4)若不加入Fe粉,就会同时产生TiO(OH)2和Fe(OH)3.导致制取的物质纯度不高。所以加入铁屑将Fe3+转化为Fe2+避免使Fe3+和TiO2+共沉淀。
练习册系列答案
相关题目


 2I-+S4O62-)
2I-+S4O62-)