题目内容
【题目】煤是重要的化石燃料和化工原料,有关煤的综合利用得到广泛深入的研究。其中煤的气化是煤的综合利用的重要途径。
煤的催化气化生成CO,主要反应为①C(s)+CO2(g)![]() 2CO(g)△H
2CO(g)△H
碱金属催化剂显示出了优越的催化性能。Mckee和Chatterji在1975年提出了由碱金属的氧化还原循环的氧传递机理:
②K2CO3(s)+2C(s)![]() 2K(g)+3CO(g) △H1=+899.4kJ/mol
2K(g)+3CO(g) △H1=+899.4kJ/mol
③2K(g)+CO2(g)![]() K2O(s)+CO(g) △H2=-98.4k/mol
K2O(s)+CO(g) △H2=-98.4k/mol
④K2O(s)+CO2(g)![]() K2CO3(s) △H3=-456.0kJ/mol
K2CO3(s) △H3=-456.0kJ/mol
(1)△H=_____________。

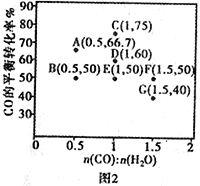
(2)在2L的密闭容器中投入3molC和3molCO2,在催化剂的作用下发生反应①,平衡时CO的气体体积分数φ(CO)随温度和压强的变化曲线如图1所示,根据图像回答问题:
①若在温度为900℃,压强为P的条件下,经过10min反应达到平衡,则0~10min内的反应速率v(CO)为_____________。
②该可逆反应达到平衡状态的标志是_____________ (填字母)
A.v(CO)正=2v(CO2)逆 B.CO2和CO的浓度之比为1∶2
C.容器内的总压强不再随时间而变化 D.混合气体的密度不再随时间而变化
③图中压强的大小顺序_______________,判断理由是_______________。
④可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算(分压=总压×物质的量分数)。反应①在图中A点的总压强为1MPa,则A点的平衡常数Kp=_____________。
(3)化石燃料燃烧易造成污染,“湿式吸收法”利用吸收剂与SO2发生反应从而达到燃料脱硫的目的。下列适合作该法吸收剂的是___________(填序号)。
A.氨水 B.Na2SO4溶液 C.Na2CO3溶液 D.NaHSO4溶液
【答案】 +172.5kJ/mol 0.2mol/(L·min) A、C、D p1<p2<p3<p4 理由:该反应的正反应方向是气体体积增大的方向,增大压强平衡向逆反应方向进行,CO的气体体积分数减少 3.2MPa A、C
【解析】(1)②K2CO3(s)+2C(s)![]() 2K(g)+3CO(g) △H1=+899.4kJ/mol
2K(g)+3CO(g) △H1=+899.4kJ/mol
③2K(g)+CO2(g)![]() K2O(s)+CO(g) △H2=-98.4k/mol
K2O(s)+CO(g) △H2=-98.4k/mol
④K2O(s)+CO2(g)![]() K2CO3(s) △H3=-456.0kJ/mol
K2CO3(s) △H3=-456.0kJ/mol
(②+③+④)/2 得目标反应C(s)+CO2(g)![]() 2CO(g) 所以△H =(△H1+△H2+ △H3)/2 = +172.5kJ/mol.答案:+172.5kJ/mol。
2CO(g) 所以△H =(△H1+△H2+ △H3)/2 = +172.5kJ/mol.答案:+172.5kJ/mol。
(2) C(s) + CO2(g) ![]() 2CO(g)
2CO(g)
初始量 3mol 3molCO2 0
变化量 X X 2X
平衡量 3-X 3-X 2X
由图像可知温度为900℃,时CO(g)气体的体积分数为80![]() 所以2X/(3-x+2x)x100
所以2X/(3-x+2x)x100![]() =80
=80![]()
X=2mol,0~10min内的反应速率v(CO)为2mol/(2Lx10min)= 0.2mol/(L·min).答案:0.2mol/(L·min)。
②A.v(CO)正=2v(CO2)逆 因为C(s)+CO2(g)![]() 2CO(g) 所以A可以判断达到平衡的依据, B.CO2和CO的浓度之比为1∶2,不能作为判断平衡的依据;C.容器内的总压强不再随时间而变化,因两边计量数不等,所以 C可以作为判断平衡的依据; D.混合气体的密度不再随时间而变化,因为反应物有固体参加,所以D能作为判断平衡的依据;答案:A C D。
2CO(g) 所以A可以判断达到平衡的依据, B.CO2和CO的浓度之比为1∶2,不能作为判断平衡的依据;C.容器内的总压强不再随时间而变化,因两边计量数不等,所以 C可以作为判断平衡的依据; D.混合气体的密度不再随时间而变化,因为反应物有固体参加,所以D能作为判断平衡的依据;答案:A C D。
③C(s)+CO2(g)![]() 2CO(g) △H =+172.5kJ/mol.为吸热反应,温度升高,平衡正向移动,正反应是气体体积增加方向,所以压强的大小顺序p1<p2<p3<p4 。判断理由是该反应的正反应方向是气体体积增大的方向,增大压强平衡向逆反应方向进行,CO的气体体积分数减少 。
2CO(g) △H =+172.5kJ/mol.为吸热反应,温度升高,平衡正向移动,正反应是气体体积增加方向,所以压强的大小顺序p1<p2<p3<p4 。判断理由是该反应的正反应方向是气体体积增大的方向,增大压强平衡向逆反应方向进行,CO的气体体积分数减少 。
④A点CO的体积分数为80![]() ,反应体系中的总压强为1MPa,CO的分压=总压×物质的量分数=0.8 MPa A点的平衡常数Kp=(0.8 MPa)2/(1-0.8) MPa= 3.2MPa.答案:3.2MPa。
,反应体系中的总压强为1MPa,CO的分压=总压×物质的量分数=0.8 MPa A点的平衡常数Kp=(0.8 MPa)2/(1-0.8) MPa= 3.2MPa.答案:3.2MPa。
(3) A.氨水可以和SO2反应,,故a正确;B B.Na2SO4溶液 D.NaHSO4溶液与SO2不反应,故B D不行;二氧化硫与亚硫酸钠溶液反应生成亚硫酸氢钠,反应方程式为:![]() ═
═![]() ,故C正确;;因此,本题正确答案是:A、B、C。
,故C正确;;因此,本题正确答案是:A、B、C。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案