��Ŀ����
����Ŀ��������һ������������Դ����������ȡ�봢��������Դ����������о��ȵ㡣
��1��ֱ���ȷֽⷨ���⡣ij�¶�����H2O(g)![]() H2(g)+
H2(g)+![]() O2(g)���÷�Ӧ��ƽ�ⳣ������ʽΪK=_____��
O2(g)���÷�Ӧ��ƽ�ⳣ������ʽΪK=_____��
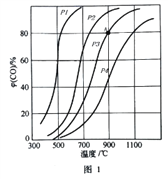
��2���Ҵ�ˮ�����������⡣�䲿�ַ�Ӧ���̺ͷ�Ӧ��ƽ�ⳣ�����¶ȱ仯������ͼ1��ʾ��

��Ӧ����ij�¶���ÿ����1mol H2(g) �����仯��62 kJ������¶���ͼ1��ʾ��Ӧ���Ȼ�ѧ����ʽ��______________________________________��
��3��ˮú�������⡣CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H <0���ڽ�����[n(CO)��n(H2O)]��ͬʱ�������Ӧ��CO��ƽ��ת���ʼ�ͼ2�������Ӧ�ķ�Ӧ�¶ȿ�����ͬ��Ҳ���ܲ�ͬ����
CO2(g)+H2(g) ��H <0���ڽ�����[n(CO)��n(H2O)]��ͬʱ�������Ӧ��CO��ƽ��ת���ʼ�ͼ2�������Ӧ�ķ�Ӧ�¶ȿ�����ͬ��Ҳ���ܲ�ͬ����

����ά�ֺ��µ�2L�ܱ������м���һ������CO��0.lmol H2O(g)����ͼ��G���Ӧ�¶��·�Ӧ��5min �ﵽƽ������v(CO) ����_________mol/(L��min)
��ͼ��B��E �����Ӧ�ķ�Ӧ�¶ȷֱ�ΪTB��TE�ж���TB______TE ���<����=����>������
����������A��E ��G�����Ӧ�ķ�Ӧ�¶ȶ���ͬΪT�棬��ԭ����A��E ��G�����Ӧ��_____________��ͬ��
����T��ʱ������һ�ݻ��ɱ���ܱ�������ͬʱ����3.0 mol CO��1.0 mol H2O��1.0mol CO2��x mol H2��Ҫʹ������Ӧ��ʼʱ������Ӧ�����������xӦ�����������_________________________________��
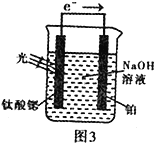
��4����绯ѧ�ֽ����⡣��ԭ����ͼ3�������ȹ�缫�ĵ缫��ӦΪ��4OH--4e-![]() O2+2H2O
O2+2H2O
�缫�ĵ缫��ӦΪ_______________________________��
��5��Mg2Cu��һ�ִ���Ͻ�350��ʱ��Mg2Cu��H2��Ӧ������Mg2Cu�ͽ���һ�ֽ���Ԫ�ص��⻯�������������������ԼΪ0.077����Mg2Cu��H2��Ӧ�Ļ�ѧ����ʽΪ___________________________��
���𰸡� K=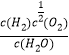 CH3CH2OH(g)+H2O(g)==4H2(g)+2CO(g) ��H=+248kJ��mol-1 0.006 > ��ѧƽ�ⳣ������K�� 0��x��3����x<3Ҳ���֣� 2H2O+2e-==H2��+ 2OH- 2Mg2Cu +3H2
CH3CH2OH(g)+H2O(g)==4H2(g)+2CO(g) ��H=+248kJ��mol-1 0.006 > ��ѧƽ�ⳣ������K�� 0��x��3����x<3Ҳ���֣� 2H2O+2e-==H2��+ 2OH- 2Mg2Cu +3H2![]() MgCu2+3MgH2
MgCu2+3MgH2
����������1��ij�¶��£�H2O(g)![]() H2(g)+
H2(g)+![]() O2(g)���÷�Ӧ��ƽ�ⳣ������ʽΪK=
O2(g)���÷�Ӧ��ƽ�ⳣ������ʽΪK=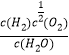 ����2������ͼ����Ϣ��֪����ӦΪCH3CH2OH(g)+H2O(g)==4H2(g)+2CO(g)�������¶�Kֵ����˵��ƽ��������Ӧ�����ƶ�������Ӧ��ת���ȷ�Ӧ��ij�¶���ÿ����1mol H2(g) �����仯��62 kJ������H=+��62
����2������ͼ����Ϣ��֪����ӦΪCH3CH2OH(g)+H2O(g)==4H2(g)+2CO(g)�������¶�Kֵ����˵��ƽ��������Ӧ�����ƶ�������Ӧ��ת���ȷ�Ӧ��ij�¶���ÿ����1mol H2(g) �����仯��62 kJ������H=+��62![]() 4��kJ��mol-1=+248kJ��mol-1�����ȷ�Ӧ����ʽΪCH3CH2OH(g)+H2O(g)==4H2(g)+2CO(g) ��H=+248kJ��mol-1��(3) ����ά�ֺ��µ�2L�ܱ������м���һ������CO��0.lmol H2O(g)����ͼ��G�������[n(CO)��n(H2O)]=1.5����ʼʱn(CO)= 0.l5mol��CO��ƽ��ת����Ϊ40%�������ĵ�CO�����ʵ���Ϊ0.06mol����Ӧ�¶��·�Ӧ��5min �ﵽƽ������v(CO) ����
4��kJ��mol-1=+248kJ��mol-1�����ȷ�Ӧ����ʽΪCH3CH2OH(g)+H2O(g)==4H2(g)+2CO(g) ��H=+248kJ��mol-1��(3) ����ά�ֺ��µ�2L�ܱ������м���һ������CO��0.lmol H2O(g)����ͼ��G�������[n(CO)��n(H2O)]=1.5����ʼʱn(CO)= 0.l5mol��CO��ƽ��ת����Ϊ40%�������ĵ�CO�����ʵ���Ϊ0.06mol����Ӧ�¶��·�Ӧ��5min �ﵽƽ������v(CO) ����![]() =0.006mol/(L��min)������֪��ӦCO(g)+H2O(g)
=0.006mol/(L��min)������֪��ӦCO(g)+H2O(g)![]() CO2(g)+H2(g) ��H <0Ϊ���ȷ�Ӧ�������¶�ƽ�������ƶ���CO��ת���ʼ�С��ͼ��B��E�����Ӧ�ķ�Ӧ���¶ȷֱ�ΪTB��TE������Ľ�����[n(CO)��n(H2O)]E��Ĵ�CO��ת������ȣ�˵��ˮ��ת����E��Ĵ��൱��ƽ�������ƶ�����Ӧ��Ϊ�����¶ȣ�TB>TE��������4������װ��ͼ�еĵ���������������缫��ԭ�����������Һ�������ӵõ����������������缫��ӦΪ��2H2O+2e-=H2��+2OH-����5����Mg2Cu��ΪMgCu2����֪Mg�����½��������������⻯�������һ�ֽ���Ԫ�ر�ΪMg���ٸ������������������Ϊ0.077����Mg��H���ʵ���֮��Ϊ
CO2(g)+H2(g) ��H <0Ϊ���ȷ�Ӧ�������¶�ƽ�������ƶ���CO��ת���ʼ�С��ͼ��B��E�����Ӧ�ķ�Ӧ���¶ȷֱ�ΪTB��TE������Ľ�����[n(CO)��n(H2O)]E��Ĵ�CO��ת������ȣ�˵��ˮ��ת����E��Ĵ��൱��ƽ�������ƶ�����Ӧ��Ϊ�����¶ȣ�TB>TE��������4������װ��ͼ�еĵ���������������缫��ԭ�����������Һ�������ӵõ����������������缫��ӦΪ��2H2O+2e-=H2��+2OH-����5����Mg2Cu��ΪMgCu2����֪Mg�����½��������������⻯�������һ�ֽ���Ԫ�ر�ΪMg���ٸ������������������Ϊ0.077����Mg��H���ʵ���֮��Ϊ![]() ��
��![]() ������ѧʽΪMgH2����Ӧ�Ļ�ѧ����ʽΪ��2Mg2Cu��3H2
������ѧʽΪMgH2����Ӧ�Ļ�ѧ����ʽΪ��2Mg2Cu��3H2![]() MgCu2��3MgH2��
MgCu2��3MgH2��

 �Ķ��쳵ϵ�д�
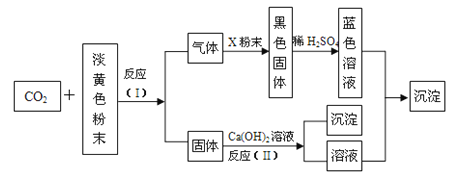
�Ķ��쳵ϵ�д�����Ŀ��ijʵ�����С��������һ�ִӷϾɵĺ�������(��Ҫ�ɷ�ΪNiO������Fe2O3��CaO��CuO��BaO�ȣ����������¹��ա�������������ͼ��
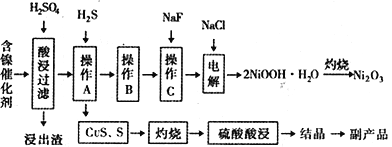
�ش�����������
��1����������Ҫ�ɷ�ΪCaSO4����2H2O��_______________�������ʡ�
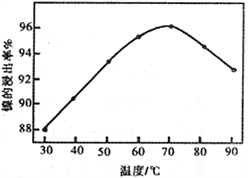
��2����ͼ��ʾ���Ľ��������¶ȵĹ�ϵ���������¶ȸ���70��ʱ�����Ľ����ʽ�������������Ni(OH)2����������ԭ����_____________________________��
��3�����������еġ�����Ʒ��Ϊ________���ѧʽ����
��4����֪�й��������↑ʼ�����ͳ�����ȫ��pH ���±���
�������� | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
��ʼ������pH | 1.5 | 6.5 | 7.7 |
������ȫ��pH | 3.7 | 9.7 | 9.2 |
����B��Ϊ�˳�ȥ��Һ�е���Ԫ�أ�ijͬѧ���������ʵ�鷽���������A���õ���Һ�м���NaOH��Һ��������ҺpHΪ3.7��7.7�����ã����ˡ���Ը�ʵ�鷽���Ƿ���ȷ�����жϲ����������� ___________________________________����ԭ������ȷ����˵�����ɣ���ԭ������������Ը�������
��5������C��Ϊ�˳�ȥ��Һ�е�Ca2+����������Һ��F��Ũ��Ϊ3��10-3mol��L-1������Һ��![]() =________________��������ʱ��Ksp(CaF2)=2.7��10-11��
=________________��������ʱ��Ksp(CaF2)=2.7��10-11��
��6��������2NiOOH��H2O��ԭ����������
�ټ���������Cl-������������ΪClO-������1mol ClO-������OH-______________mol��
��Ni2+��ClO-��������2NiOOH��H2O��������ò���Ӧ�����ӷ���ʽΪ_________________________��