题目内容
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知: ① Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O ② SO2+SeO2+ H2O ![]() Se + SO42-+ H+
Se + SO42-+ H+
(1)依据Se与浓H2SO4的反应,写出Se和浓HNO3(还原产物为NO2)反应的化学方程式:__________________。
(2)Se与浓HNO3的反应中,氧化剂是_______, 反应中被还原的元素是_______。当有标准状况下33.6LNO2气体生成时,转移电子的物质的量是________mol。
(3)依据反应①②, 判断SeO2、浓H2SO4、SO2的氧化性由强到弱的顺序是__________。
(4) 配平反应②, 并用双线桥法标出电子转移的方向和数目:_____________________。
【答案】Se+4HNO3(浓)===== SeO2+4NO2↑+2H2O 浓HNO3 N 1.5 浓H2SO4 > SeO2 > SO2 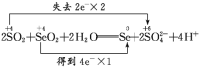
【解析】
利用题中信息可知Se与浓HNO3反应,Se被氧化为+4价的SeO2,浓HNO3还原为NO2;反应中浓HNO3做氧化剂,N元素被还原;在氧化还原反应中,氧化剂的氧化性强于氧化产物,还原剂的还原性强于还原产物;SO2与SeO2反应中,SO2做还原剂,被氧化为H2SO4,SeO2做氧化剂,被还原为单质Se,进而确定各物质的量的系数配平方程式,确定转移电子数目,标出电子转移的方向和数目。
(1)利用题中信息可知Se与浓HNO3反应,Se被氧化为+4价的SeO2,反应中S元素化合价升高4,浓HNO3还原为NO2,反应中化合价降低1,化合价升降最小公倍数为4,由化合价升降法配平得反应的化学方程式:Se+4HNO3(浓)=SeO2+4NO2↑+2H2O。(2)反应中浓HNO3做氧化剂,N元素被还原;标准状况下33.6LNO2气体的物质的量为1.5mol,反应转移的电子数目为1.5mol×1=1.5mol。(3)在氧化还原反应中,氧化剂的氧化性强于氧化产物,所以根据反应的方程式可知,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>SO2。(4)SO2与SeO2反应中,SO2做还原剂,被氧化为H2SO4,化合价升高2,SeO2做氧化剂,被还原为单质Se,Se元素化合价降低4,化合价升降最小公倍数为4,由化合价升降法配平得反应的化学方程式:2SO2+SeO2+ 2H2O=Se +2SO42-+4 H+,用双线桥法标出电子转移的方向和数目如下: 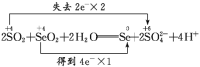 。
。