题目内容
【题目】氮元素能够形成多种化合物。请回答下列问题:
(1)联氨(N2H4)在空气中迅速完全燃烧生成N2,同时放大量热,可作火箭的燃料。
已知:H2(g)+1/2O2(g)==H2O(g) △H1=-241.8kJ/mol
N2(g)+2H2(g)=N2H4(l) △H2=+50.6kJ/mol
H2O(g)= H2O(l) △H3=-44kJ/mol
则N2H4(l)在空气燃烧生成N2和气态水的热化学方程式为________________________。
(2)汽车尾气中的氮氧化物是形成酸雨的气体之一,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图。写出该脱硝原理总反应的化学方程式:___________________________。

(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH= a kJ/mol
N2(g)+CO2(g) ΔH= a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如下:

根据图表数据分析T1℃时:
①该反应在0-20min的平均反应速率v(NO)= _________ ;
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 _________(填字母)。
A.通入一定量的CO2
B.加入合适的催化剂
C.适当缩小容器的体积
D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则a _____0(填“>”或“<”)。
(4)电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。下图是一种电解法合成氨的装置图。则b电极上的电极反应式为__________________________。

(5)AgCl能溶于氨水,发生反应AgCl(s)+2NH3(aq) ![]() Ag(NH3)2+(aq) +Cl-(aq),其平衡常数K=1.936×10-3。现用1L某浓度氨水(溶质视为NH3)完全溶解0.1molAgCl,所需氨水浓度至少为________。(写出表达式即可)
Ag(NH3)2+(aq) +Cl-(aq),其平衡常数K=1.936×10-3。现用1L某浓度氨水(溶质视为NH3)完全溶解0.1molAgCl,所需氨水浓度至少为________。(写出表达式即可)
【答案】 N2H4(l)+ O2(g)== N2(g)+2H2O(g) △H=-534.2kJ/mol 6NO+3O2+2C2H4![]() 4CO2+3N2+4H2O 0.030mol·L-1 ·min-1 CD < N2 + 3H2O + 6e- =2NH3 + 3O2- (
4CO2+3N2+4H2O 0.030mol·L-1 ·min-1 CD < N2 + 3H2O + 6e- =2NH3 + 3O2- (![]() +0.2) mol/L
+0.2) mol/L
【解析】(1)①H2(g)+1/2O2(g)==H2O(g) △H1=-241.8kJ/mol,②N2(g)+2H2(g)=N2H4(l) △H2=+50.6kJ/mol,③H2O(g)= H2O(l) △H3=-44kJ/mol,根据盖斯定律,将①×2-②得:N2H4(l)+ O2(g)== N2(g)+2H2O(g) △H=(241.8kJ/mol)×2-(+50.6kJ/mol)=-534.2kJ/mol,故答案为:N2H4(l)+ O2(g)== N2(g)+2H2O(g) △H=-534.2kJ/mol;
(2)①图1可知,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O,反应总方程式为6NO+3O2+2C2H4![]() 3N2+4CO2+4H2O,故答案为:6NO+3O2+2C2H4
3N2+4CO2+4H2O,故答案为:6NO+3O2+2C2H4![]() 3N2+4CO2+4H2O;
3N2+4CO2+4H2O;
(3)①T1℃时,该反应在0-20min的平均反应速率v(NO)= ![]() =0.030molL-1min-1,故答案为:0.030molL-1min-1;
=0.030molL-1min-1,故答案为:0.030molL-1min-1;
②A.通入一定量的CO2,平衡逆向移动,NO的浓度增大,但是氮气的浓度会减少,与题不符,故A错误;B.催化剂只改变化学反应速率,不改变化学平衡,故B错误;C.适当缩小容器的体积,反应前后体积不变,平衡状态物质浓度增大,故C正确;D.通入一定量的NO,新平衡状态下物质平衡浓度增大,故D正确;E.加入一定量的活性炭,碳是固体对平衡无影响,平衡不动,故E错误;故答案为:CD;
③30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比从为2:1:1,氮气和二氧化碳浓度之比始终为1:1,所以2:1>4:3,说明平衡向逆反应方向移动,说明平衡向逆反应方向移动,达到新平衡时NO的转化率,说明逆反应是吸热反应,则正反应是放热反应,故答案为:<;
(4)阴极上氮气得电子生成氨气,电极方程式为:N2+3H2O+6e-=2NH3+3O2-,故答案为:N2+3H2O+6e-=2NH3+3O2-;
(5)AgCl(s)+2NH3(aq) ![]() Ag(NH3)2+(aq) +Cl-(aq),用1L某浓度氨水完全溶解0.1molAgCl,Ag(NH3)2+和Cl-的浓度均为0.1mol/L,根据K=1.936×10-3=
Ag(NH3)2+(aq) +Cl-(aq),用1L某浓度氨水完全溶解0.1molAgCl,Ag(NH3)2+和Cl-的浓度均为0.1mol/L,根据K=1.936×10-3= =
=![]() 解得平衡时
解得平衡时![]() =
=![]() mol/L=
mol/L=![]() mol/L,因此所需氨水浓度至少=
mol/L,因此所需氨水浓度至少=![]() mol/L+0.2 mol/L=(
mol/L+0.2 mol/L=(![]() +0.2)mol/L,故答案为:(
+0.2)mol/L,故答案为:(![]() +0.2)mol/L。
+0.2)mol/L。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填空.
(1)如图1是常见仪器的部分结构.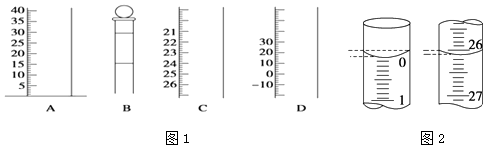
①写出仪器名称BC
②使用前需检查是否漏水的仪器有 .
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 . 滴定终点时,锥形瓶中颜色变化为 , 且半分钟内颜色不复原.
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)若滴定开始和结束时,酸式滴定管中的液面如图2所示,所用盐酸溶液的体积为mL.
(5)某学生根据3次实验分别记录有关数据如表:
滴定 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
第二次 | 25.00 | 0.56 | 30.56 | 30.00 |
第三次 | 25.00 | 0.22 | 25.11 | 24.89 |
依据表数据列式计算该NaOH溶液的物质的量浓度 . (保留两位有效数字)
