题目内容
加热N2O5时,发生以下两个反应:N2O5 N2O3 + O2,N2O3
N2O3 + O2,N2O3 N2O + O2。在1L密闭容器中加热4molN2O5,达到平衡时,c(O2)为4.5mol?L-1,c(N2O3) 为1.62mol?L-1,则c(N2O5) 为( )
N2O + O2。在1L密闭容器中加热4molN2O5,达到平衡时,c(O2)为4.5mol?L-1,c(N2O3) 为1.62mol?L-1,则c(N2O5) 为( )
| A.1.44mol?L-1 | B.3.48mol?L-1 | C.0.94mol?L-1 | D.1.98mol?L-1 |
C
解析试题分析:假设发生N2O5 N2O3 + O2,产生的N2O3和O2的浓度为X,其中发生N2O3
N2O3 + O2,产生的N2O3和O2的浓度为X,其中发生N2O3 N2O + O2改变的浓度为Y。则X-Y=1.62mol/L;X+Y=4.5mol/L解得X=3.06mol/L;Y=1.44mol/L。则达到平衡时c(N2O5)= 4mol/L-3.06mol/L=0.94mol/L.因此选项为C。
N2O + O2改变的浓度为Y。则X-Y=1.62mol/L;X+Y=4.5mol/L解得X=3.06mol/L;Y=1.44mol/L。则达到平衡时c(N2O5)= 4mol/L-3.06mol/L=0.94mol/L.因此选项为C。
考点:考查物质达到平衡时浓度的计算的知识。

练习册系列答案
相关题目
下列叙述表示可逆反应N2 + 3H2 2NH3一定处于平衡状态的是……… ( )
2NH3一定处于平衡状态的是……… ( )
| A.N2、H2、NH3的百分含量相等 | B.3v(N2)正= v(H2)逆 |
| C.定容容器中,气体的密度不变 | D.N2、H2、NH3的浓度之比为1:3:2 |
下列有关工业生产的叙述正确的是
| A.合成氨工业中,将NH3及时液化分离有利于加快反应速率 |
| B.氯碱工业中,使用离子交换膜可防止C12和NaOH溶液反应 |
| C.硫酸工业中,接触室内安装热交换器,是为了利用沸腾炉中排出的SO2的热量 |
| D.硫酸工业中,SO2的催化氧化不采用高压,是因为压强对SO2转化率无影响 |
对于在恒温恒容容器中进行的反应A(g)+2B(g) 3C(g)+D(g),以下不能说明已达平衡状态的是
3C(g)+D(g),以下不能说明已达平衡状态的是
| A.反应容器中,压强不随时间改变而改变 |
| B.单位时间内生成3nmolC的同时生成nmolA |
| C.反应容器中,混合气体的平均相对分子质量不再改变 |
| D.反应容器中的气体密度不随时间变化 |
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是( )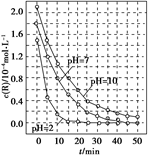
| A.在0-50 min之间, pH = 2和PH = 7时R的降解百分率不相等 |
| B.在 20-25 min之间, pH =" 10" 时R的平均降解速率为0.04 mol?L-1?min-1 |
| C.溶液酸性越强, R 的降解速率越小 |
| D.R的起始浓度和溶液的PH均影响R的降解速率 |
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是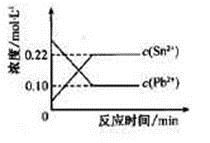
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如下图所示。下列判断正确的是
| A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等 |
| B.溶液酸性越强,R的降解速率越小 |
| C.R的起始浓度越小,降解速率越大 |
| D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1 |
下列说法正确的是( )
| A.一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的ΔH>0 ΔS>0 |
| B.凡是放热反应都是自发的,凡是吸热反应都是非自发的 |
C.常温下,2H2O 2H2↑+O2↑,即常温下水的分解反应是自发反应 2H2↑+O2↑,即常温下水的分解反应是自发反应 |
| D.对于反应H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |