题目内容
【题目】丙烯酸甲酯(CH2=CHCOOCH3)是一种重要的有机化工原料。实验室制备少量丙烯酸甲酯的反应为:CH2=CHCOOH+CH3OH![]() CH2=CHCOOCH3+H2O,步骤如下:
CH2=CHCOOCH3+H2O,步骤如下:
步骤1:在100mL圆底烧瓶中依次加入10.0g丙烯酸、少许碎瓷片、10mL甲醇和2mL浓硫酸,搅拌。
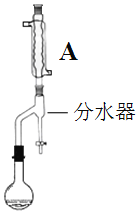
步骤2:如图,连接装置,加热烧瓶中的混合液,用锥形瓶盛接通过分水器分离出的水。当不再有水生成,停止加热。
步骤3:反应液冷却后,依次用5%Na2CO3溶液、饱和食盐水、水洗涤。分离出有机相。
步骤4;向有机相中加无水Na2SO4固体,过滤后蒸馏,收集70~90℃馏分。测得丙烯酸甲酯的质量为6.45g。
可能用到的信息:
密度 | 沸点 | 溶解性 | ||
丙烯酸 | 1.05g·cm-3 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
甲醇 | 0.79g·cm-3 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
丙烯酸甲酯 | 0.95g·cm-3 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
请回答下列问题:
(1)步骤1中,加入碎瓷片的目的是________。
(2)步骤2中,图中所示装置中仪器A的名称是______,其作用为_______。
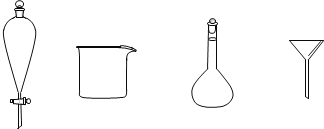
(3)步骤3中,用5%Na2CO3溶液洗涤后,分离有机相的操作名称为_______,分离有机相时不需要用到下列玻璃仪器中的_______(填名称)。
(4)实验中可能生成的有机副产物结构简式为_______ (填一种即可)。
(5)本实验中丙烯酸甲酯的产率为______%。
【答案】防止暴沸 球形冷凝管 冷凝回流 分液 容量瓶,漏斗; CH3OCH3 75%
【解析】
(1)根据碎瓷片作用进行分析;
(2)根据仪器A的构造进行分析;
(3)根据分离互不相溶的液体所需的仪器进行分析;
(4)在浓硫酸加热的条件下,醇分子间可发生脱水生成醚的反应;
(5)根据甲醇和丙烯酸反应方程式得出,二者1:1反应,说明甲醇过量,所以根据丙烯酸的物质的量计算丙烯酸甲酯的理论产量,根据实际产量/理论产量×100%可求出产率。
(1)步骤1中,加入碎瓷片的目的是为了防止爆沸;
故答案是:防止暴沸;
(2)仪器A的名称是球形冷凝管,冷凝管的作用为冷凝回流;
故答案是:球形冷凝管;冷凝回流;
(3)分离有机相和水,可以通过分液的方式进行操作;需要的仪器有:分液漏斗和烧杯,用不到的仪器主要有容量瓶和漏斗;
故答案是:分液;容量瓶,漏斗;
(4)实验的条件为浓硫酸加热,可发生甲醇分子间脱水反应生成甲醚的副反应;
故答案是:CH3OCH3;
(5)根据表中数据得出,甲醇有7.9g,丙烯酸有10g,所以甲醇有0.25mol,丙烯酸有0.11mol,根据反应方程式得出,二者1:1反应,说明甲醇过量,所以根据丙烯酸的物质的量计算,0.11mol丙烯酸理论上可以生成0.11mol的丙烯酸甲酯,所以理论丙烯酸甲酯的产量为8.6g,所以计算产率得到![]() ×100%=75%;
×100%=75%;
故答案是:75%。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】在Na+浓度为0.5 mol·L-1的某澄清溶液中,还可能还有K+、Ag+、Ca2+、Ba2+、NO3-、CO32-、SiO32-、SO42-中的若干种,现取该溶液100mL进行如下实验
已知:H2SiO3为不容水的胶状沉淀,加热时易分解为两种物质
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 生成白色胶状沉淀并放出标况下0.56L气体 |
Ⅱ | 将Ⅰ中产生的混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题:
(1)实验Ⅰ能确定一定存在的离子是______________;一定不存在的离子是____________。
(2)实验Ⅱ中沉淀洗涤、灼烧至恒重,所涉及的化学方程式为____________________;
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,求K+的最小浓度_______________。