题目内容
【题目】I.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。
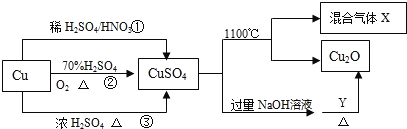
(1)比较途径①②③,途径_______更好地体现了绿色化学思想,其反应的化学方程式:_____
(2)CuSO4在1100℃分解所得气体X可能是SO2、SO3和另一种气体的混合气体,请写出相关化学方程式:________________________。
II.工业上用铝土矿(主要成分为Al2O3·xH2O、Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料,提取时操作过程如下图
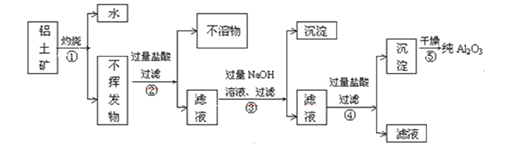
(1)指出图中操作错误的两处是:________________。
(2)步骤②过滤的不溶物是:__________________。
(3)写出步骤③反应(得到④滤液)的主要离子方程式:_________________。
【答案】② Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 2CuSO4
CuSO4+SO2↑+2H2O 2CuSO4 Cu2O+SO2↑+SO3↑+O2↑ 步骤④加入过量盐酸无法得到氢氧化铝沉淀;步骤⑤只干燥氢氧化铝沉淀无法得到氧化铝 SiO2 Al3++4OH-=AlO2-+2H2O
Cu2O+SO2↑+SO3↑+O2↑ 步骤④加入过量盐酸无法得到氢氧化铝沉淀;步骤⑤只干燥氢氧化铝沉淀无法得到氧化铝 SiO2 Al3++4OH-=AlO2-+2H2O
【解析】
I.(1)途径①涉及反应为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;途径②涉及反应为2Cu+2H2SO4+O2=2CuSO4+2H2O;途径③涉及反应为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;根据方程式可知途径②中产物无污染,体现了绿色化学思想;
CuSO4+SO2↑+2H2O;根据方程式可知途径②中产物无污染,体现了绿色化学思想;
(2)根据题目信息可知硫酸铜在1100℃分解的产物中有Cu2O、SO2和SO3,根据元素守恒和电子守恒可知另外一种气体为氧气,方程式为:2CuSO4 Cu2O+SO2↑+SO3↑+O2↑;
Cu2O+SO2↑+SO3↑+O2↑;
II. 铝土矿灼烧除去结晶水,灼热后的不挥发物质中加入过量的盐酸,Al2O3、Fe2O3溶解成铝盐、铁盐,过滤除去不溶的杂质二氧化硅等,溶液中含有过量的盐酸,向②的滤液中加入过量氢氧化钠使铝盐变成偏铝酸盐,而铁离子转化为氢氧化铁沉淀,过滤除去,滤液中含有过量的氢氧化钠,向③的滤液中加入过量盐酸,溶液中偏铝酸根、氢氧化钠转化为氯化铝、氯化钠,溶液溶质为氯化铝、氯化钠,不能生成氢氧化铝沉淀,应通入二氧化碳,可得氢氧化铝沉淀,图示步骤有误;灼烧氢氧化铝沉淀分解生成氧化铝,只干燥得不到氧化铝,图示步骤有误。
(1)根据分析可知:步骤④加入过量盐酸无法得到氢氧化铝沉淀;步骤⑤只干燥氢氧化铝沉淀无法得到氧化铝;
(2)根据分析可知步骤②过滤的不溶物是二氧化硅;
(3)步骤③得到滤液④的反应为氯化铝与过量氢氧化钠的反应,离子方程式为:Al3++4OH-=AlO2-+2H2O。

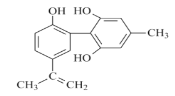
【题目】肉桂酸是合成香料、化妆品、医药、浆料和感光树脂等的重要原料,其结构简式是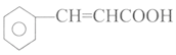 。
。
I.写出肉桂酸的反式结构: __________。
II.实验室可用下列反应制取肉桂酸。
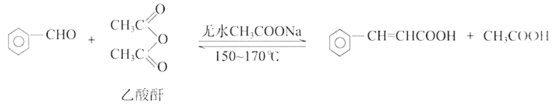
已知药品的相关数据如下:
苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
溶解度(25℃,g/100g 水) | 0.3 | 遇水水解 | 0.04 | 互溶 |
相对分子质量 | 106 | 102 | 148 | 60 |
实验步骤如下:
第一步合成:向烧瓶中依次加入研细的无水醋酸钠、5.3g 苯甲醛和6.0g乙酸酐,振荡使之混合均匀。在150~ 170℃加热1小时,保持微沸状态。第二步粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,并进行下列操作:
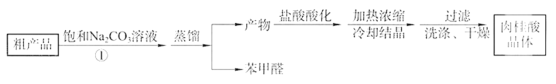
请回答下列问题。
(1)检验粗产品中含有苯甲醛的实验方案是:取粗产品于试管中,加水溶解,滴入NaOH溶液,将溶液调至碱性, _________。
(2)步骤①中肉桂酸与Na2CO3溶液反应的化学方程式是_________。
(3)若最后得到4.81g纯净的肉桂酸,则该反应中肉桂酸的产率是_________。
(4)符合下列条件的肉桂酸的同分异构体有_________种。
i.苯环上含有三个取代基;
ii.该同分异构体遇FeCl3显色且能发生银镜反应。
写出其中任意一种同分异构体的结构简式: _________。