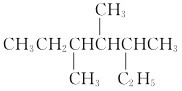
题目内容
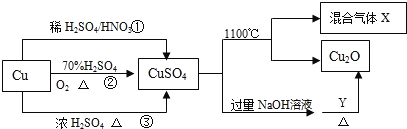
【题目】已知反应:C2H5OH+NaBr+H2SO4(浓)![]() NaHSO4+C2H5Br+H2O,实验室用如图所示装置制备溴乙烷(沸点为38.4℃,密度为1.43g·mL-1)。
NaHSO4+C2H5Br+H2O,实验室用如图所示装置制备溴乙烷(沸点为38.4℃,密度为1.43g·mL-1)。
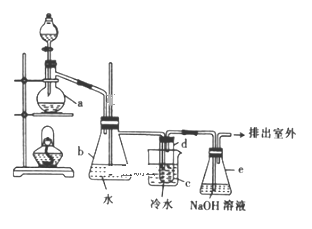
实验前先向仪器a中加入10g乙醇和足量浓硫酸,然后加入研细的20.6g溴化钠和几粒碎瓷片,向试管d中加人少量蒸馏水。
回答下列问题:
(1)加入碎瓷片的作用是__。
(2)试管d中出现的实验现象是___。
(3)反应结束后,试管d中含少量杂质Br2,为了除去粗产品中的杂质Br2,可选用的试剂是__填字母
A.苯 B.H2O C.Na2SO3溶液 D.CCl4
(4)经过分离、提纯、干燥后,该实验最终得到10.9g溴乙烷,则本实验溴乙烷的产率为___。
(5)通过以下几项实验步骤可检验溴乙烷中的溴元素,其正确的操作顺序是取少量溴乙烷___(填序号)。
①加热②加入AgNO3溶液③加入稀HNO3酸化④加入NaOH溶液⑤冷却
【答案】防止液体暴沸 液体分层,下层为油状液体 C 50% ④①⑤
【解析】
(1)加入碎瓷片可防止液体暴沸;
(2)根据溴乙烷不溶于水、密度大于水进行分析;
(3)根据溴乙烷和溴的性质,逐一分析能够和溴化氢反应且不能和溴乙烷反应试剂,注意除杂不能引进新的杂质;
(4)根据20.6g溴化钠的质量计算出理论上生成溴乙烷的物质的量,然后根据实际产生的溴乙烷的量计算出产率;
(5)检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成。
![]() 加入少量碎瓷片或者沸石,形成溶液的爆沸中心,防止液体爆沸,
加入少量碎瓷片或者沸石,形成溶液的爆沸中心,防止液体爆沸,
故答案为:防止液体暴沸;
![]() 由于溴乙烷不溶于水,所以冷却后混合液体会分层,溴乙烷密度大于水,在混合液的下层有油状液体,
由于溴乙烷不溶于水,所以冷却后混合液体会分层,溴乙烷密度大于水,在混合液的下层有油状液体,
故答案为:液体分层,下层为油状液体;
![]() 溴和溴乙烷都能溶于苯,不能将二者分离,故A错误;
溴和溴乙烷都能溶于苯,不能将二者分离,故A错误;
B.溴在溴乙烷中的溶解度比在水中大,加水难以除去溴乙烷中的![]() ,故B错误;
,故B错误;
C.溴单质和![]() 溶液发生氧化还原反应,可以除去溴单质,故C正确;
溶液发生氧化还原反应,可以除去溴单质,故C正确;
D.溴和溴乙烷都能溶于四氯化碳,不能将二者分离,故D错误;
故答案为:C;
![]() 根据
根据![]() 溴化钠的质量计算出理论上生成溴乙烷的物质的量,然后根据实际产生的溴乙烷的量计算出产率。10g乙醇的物质的量
溴化钠的质量计算出理论上生成溴乙烷的物质的量,然后根据实际产生的溴乙烷的量计算出产率。10g乙醇的物质的量![]()
![]() 溴化钠的物质的量
溴化钠的物质的量![]() ,应以溴化钠的质量为准进行计算;根据反应
,应以溴化钠的质量为准进行计算;根据反应![]() 可知,理论上生成溴乙烷的物质的量为
可知,理论上生成溴乙烷的物质的量为![]() ;
;
实际上生成溴乙烷的物质的量为![]() ,溴乙烷的产率
,溴乙烷的产率![]() ,
,
故答案为:![]() ;
;
![]() 检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,所以操作顺序为④①⑤,
检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,所以操作顺序为④①⑤,
故答案为:④①⑤。

 备战中考寒假系列答案
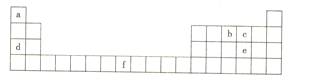
备战中考寒假系列答案【题目】X、Y、Z、M、R五种元素的原子序数依次增大,只有X、Y、Z为短周期元素,相关信息如表:
元素 | 相关信息 |
X | 基态原子核外有3个能级,且各能级电子数目相等 |
Y | 常见化合价只有0、-1、-2 |
Z | 单质为黄绿色有毒气体 |
M | 第四周期d区元素,基态原子的核外有6个未成对电子 |
R | 第五周期,与X处于同一主族 |
(1)元素X、Y电负性的大小顺序是______(用元素符号表示)。
(2)XYZ2分子中所有原子均满足8电子构型,分子中σ键与π键的数目比为______。
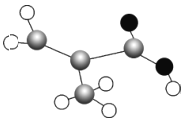
(3)元素Y可形成一种氢化物的空间结构如图所示,中心原子Y的杂化方式是______,该分子为______(填“极性”或“非极性”)分子。
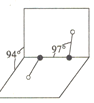
(4)元素M基态原子的价电子排布式为______,MO5中M的化合价为+6价,则该分子中含有过氧键的数目为______。
(5)元素R与Z可形成化合物RZ2,用价层电子对互斥理论推断该分子的空间构型为______,分子中Z-R-Z的键角______120°(填“>”、“=”或“<”)。
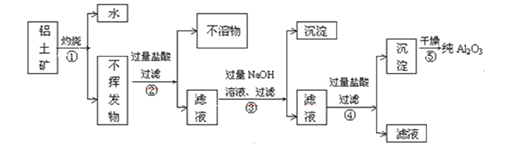
【题目】1-溴丁烷是无色透明液体,可用作制药、染料、功能性色素、香料等的原料,也可作半导体中间原料。其实验窒制备原理及流程如图:
KBr+H2SO4![]() HBr+KHSO4
HBr+KHSO4
C4H9OH+HBr![]() C4H9Br+H2O
C4H9Br+H2O

可能用到的有关数据及信息如下表:
名称 | 相对分子质量 | 沸点/℃ | 密度(g/cm3) | 水中溶解性 | 浓硫酸中溶解性 |
正丁醇 | 74 | 117.7 | 0.8098 | 微溶 | 能溶 |
1-溴丁烷 | 137 | 101.6 | 1.266 | 微溶 | 不溶 |
正丁醚 | 130 | 142 | 0.7689 | 不溶 | 反应成盐 |
回答下列问题:
(1)操作Ⅰ是用如图所示实验装置,加热仪器A中的反应物制备1-溴丁烷(加热和夹持装置均略去)。

①仪器B的作用是_________。
②若浓硫酸太浓或加热A时温度过高,均会产生大量红棕色气体,原因是________(用化学方程式表示);该制备反应中产生的有机副产物除正丁醚外,还可能有_______(填结构简式)。
③图中装置有一处错误,请提出改进建议:__________。
(2)操作Ⅱ是用如图所示实验装置蒸出1-溴丁烷粗产品(加热和夹持装置均略去)。

①仪器D的名称是_______。
②判断1-溴丁烷是否蒸完的方法是_______。
(3)操作Ⅲ是将产品转移至分液漏斗中,依次经过水、浓硫酸、水、10mL 10%碳酸钠溶液、水五次洗涤并分液,目的是除去1-溴丁烷粗产品的各种杂质。
①浓硫酸的主要作用是_______。
②用10mL 10%碳酸钠溶液洗涤时必须的操作是_______。
(4)操作N将产品用无水CaCl2干燥后再蒸馏纯化。1-溴丁烷的产率为____ (近似取整)%。