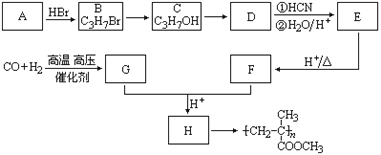
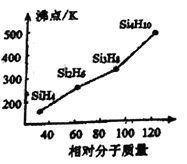
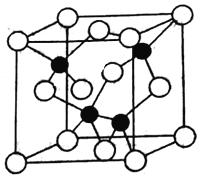
题目内容
【题目】利用CO和H2在催化剂的作用下合成甲醇,反应如下:CO(g)+2H2(g)=CH3OH(g)。在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应.测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如下图所示。下列说法正确的是
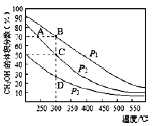
A.该反应的△H<O,且p1<p2<p3
B.在C点时,H2转化率为75%
C.反应速率:v逆(状态A)>v逆(状态B)
D.在恒温恒压条件下,向该密闭容器中再充入1molCH3OH,
达平衡时CH3OH的体积分数增大
【答案】B
【解析】
试题分析:A.升高温度,CH3OH的体积分数减小,平衡逆向移动,说明正反应为放热反应,△H<0,该反应为气体体积减小的反应,增大压强,平衡正向移动,可以提高CH3OH的体积分数,则p2<p1,A项错误;B.在C点,假设反应的CO的物质的量为x
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始120
反应x2xx
平衡1-x2-2xx
则x/[(1-x)+(2-2x)+x]×100%=50%,解得x=0.75,因此CO转化率为75%,B项正确;C.温度越高,反应速率越快,B的反应温度高,反应速率:ν逆(状态A)<ν逆(状态B),C项错误;D.在恒温恒压条件下向密闭容器中充入不同量的CH3OH,根据等效平衡的建立条件,达平衡时CH3OH的体积分数相同,D项错误;答案选B

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。
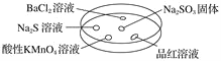
下表中对实验现象的描述或所做的解释不正确的是( )
选项 | 实验现象 | 解释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
【题目】Ⅰ.在实验室利用下列装置,可制备某些气体并验证其化学性质。

完成下列表格:
序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
(1) | 乙烯 | B→D→E | ________________ |
(2) | 乙炔 | ____________________ | _________________________ |
(3)D装置中氢氧化钠溶液的作用____________________________________。
Ⅱ.工业上用乙烯和氯气为原料,经下列各步合成聚氯乙烯(PVC):

甲的结构简式是___________________________________________________;反应(3)的化学方程式是__________________________________________________。