题目内容
 如图所示的装置,在盛有水的烧杯中,等质量的铁圈和银圈的连接在一起,吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.试回答下列问题:(相对原子质量:Fe-56,Cu-64)
如图所示的装置,在盛有水的烧杯中,等质量的铁圈和银圈的连接在一起,吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.试回答下列问题:(相对原子质量:Fe-56,Cu-64)(1)片刻后观察到的现象是(指金属圈)
(2)上述反应结束后,将两个金属圈取出,分别称重,两金属圈质量差为1.2克.再向溶液中滴加足量氯水,则发生反应的化学方程式为
(3)上述2反应结束后所得溶液体积为100mL,则反应后所得溶液中各溶质的物质的量浓度分别是(要求分别指出溶质)
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)该装置构成原电池,铁易失电子作负极、银作正极,负极反应式为Fe-2e-=Fe2+、正极反应式为Cu2++2e-=Cu;
(2)溶液中存在亚铁离子,亚铁离子能被氯气氧化生成铁离子;根据亚铁离子和转移电子之间的关系式计算;
(3)两个金属圈质量差为析出银和溶解铁的质量和,根据转移电子守恒计算溶解铁的质量,2反应结束后,溶液中的溶质为硫酸铁、氯化铁,根据原子守恒计算硫酸铁和氯化铁的物质的量浓度.
(2)溶液中存在亚铁离子,亚铁离子能被氯气氧化生成铁离子;根据亚铁离子和转移电子之间的关系式计算;
(3)两个金属圈质量差为析出银和溶解铁的质量和,根据转移电子守恒计算溶解铁的质量,2反应结束后,溶液中的溶质为硫酸铁、氯化铁,根据原子守恒计算硫酸铁和氯化铁的物质的量浓度.
解答:
解:(1)该装置构成原电池,铁易失电子作负极、银作正极,负极反应式为Fe-2e-=Fe2+、正极反应式为Cu2++2e-=Cu,铁片不断溶解、银片上质量不断增加,所以看到的现象是银圈表面变红向下沉,铁圈变细向上浮,
故答案为:银圈表面变红向下沉,铁圈变细向上浮;形成原电池,铁圈为负极,铁失电子溶解,银圈为正极,溶液中的铜离子的电子在银圈上析出;
(2)溶液中存在亚铁离子,亚铁离子能被氯气氧化生成铁离子,反应方程式为6FeSO4+3Cl2=2Fe2(SO4)3+2FeCl3,该反应中被氧化的元素是+2价Fe,两个金属圈质量差为析出银和溶解铁的质量和,设溶解铁的物质的量为xmol,根据转移电子守恒得析出铜的物质的量为xmol,则(56+64)g/mol×xmol=1.2g,x=0.01,则硫酸亚铁的物质的量为0.01mol,根据亚铁离子和转移电子之间的关系式得,转移电子数=0.01mol×NA/mol=0.01NA或6.02×1021,
故答案为:6FeSO4+3Cl2=2 Fe2(SO4)3+2FeCl3;+2价Fe;0.01NA或6.02×1021;
(3)根据(2)知硫酸亚铁的物质的量为0.01mol,根据6FeSO4+3Cl2=2Fe2(SO4)3+2FeCl3知,n(FeCl3)=n(Fe2(SO4)3)=
n(FeSO4)=
mol,所以C(FeCl3)=C(Fe2(SO4)3)=
=0.033mol/L,故答案为:C(FeCl3)=
=0.033mol/L;C(Fe2(SO4)3)=
=0.033mol/L.
故答案为:银圈表面变红向下沉,铁圈变细向上浮;形成原电池,铁圈为负极,铁失电子溶解,银圈为正极,溶液中的铜离子的电子在银圈上析出;
(2)溶液中存在亚铁离子,亚铁离子能被氯气氧化生成铁离子,反应方程式为6FeSO4+3Cl2=2Fe2(SO4)3+2FeCl3,该反应中被氧化的元素是+2价Fe,两个金属圈质量差为析出银和溶解铁的质量和,设溶解铁的物质的量为xmol,根据转移电子守恒得析出铜的物质的量为xmol,则(56+64)g/mol×xmol=1.2g,x=0.01,则硫酸亚铁的物质的量为0.01mol,根据亚铁离子和转移电子之间的关系式得,转移电子数=0.01mol×NA/mol=0.01NA或6.02×1021,
故答案为:6FeSO4+3Cl2=2 Fe2(SO4)3+2FeCl3;+2价Fe;0.01NA或6.02×1021;
(3)根据(2)知硫酸亚铁的物质的量为0.01mol,根据6FeSO4+3Cl2=2Fe2(SO4)3+2FeCl3知,n(FeCl3)=n(Fe2(SO4)3)=
| 1 |
| 3 |
| 0.01 |
| 3 |
| ||
| 0.1L |
| ||
| 0.1L |
| ||
| 0.1L |
点评:本题考查了原电池原理,根据得失电子确定正负极上发生的反应,再结合转移电子守恒进行有关计算,题目难度中等.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
以烃和水为原料可以制得CO和H2,如CH4+H2O?CO+3H2.则下列关于甲烷与水反应的说法,正确的是( )
| A、CH4既被氧化又被还原 |
| B、H2O既不是氧化剂又不是还原剂 |
| C、在反应条件下,每消耗1mol H2O必然生成67.2L H2 |
| D、建立平衡后,使用更高效的催化剂,可使H2的产率提高 |
下列说法或解释不正确的是( )
| A、等物质的量浓度的下列溶液中,①NH4Al(SO4)2②NH4Cl③CH3COONH4④NH3?H2O,c(NH4+)由大到小的顺序是:②>①>④>③ |
| B、室温下,向0.01mol?L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| C、向0.2mol?L-1NaHCO3溶液中加如等体积0.1mol?L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、对于反应N2H4(l)=N2(g)+2H2(g)△H=-50.6kJ?mol-1在任何温度下都能自发进行 |
根据以下实验事实,判断四种微粒在酸性条件下,氧化性由强到弱的顺序是( )
①向FeCl3溶液中滴加KI溶液,再加入CCl4振荡,CCl4层呈紫色;
②向FeCl2溶液中加入氯水,再加入KSCN溶液,呈红色;
③向KMnO4溶液中加入浓盐酸,振荡后紫色褪去.
①向FeCl3溶液中滴加KI溶液,再加入CCl4振荡,CCl4层呈紫色;
②向FeCl2溶液中加入氯水,再加入KSCN溶液,呈红色;
③向KMnO4溶液中加入浓盐酸,振荡后紫色褪去.
| A、I2>Cl2>Fe3+>MnO4- |
| B、MnO4->Cl2>Fe3+>I2 |
| C、Cl2>I2>Fe3+>MnO4- |
| D、Fe3+>MnO4->Cl2>I2 |

 为证明有关物质的性质,某学生设计了如图所示的装置.当打开活塞C,使液体A与隔板H上的固体B相遇时,即有气体产生,并发现D中蜡烛熄灭;关闭C 打开E时,则看到G中蜡烛燃得更亮,且F中盛放固体为淡黄色.
为证明有关物质的性质,某学生设计了如图所示的装置.当打开活塞C,使液体A与隔板H上的固体B相遇时,即有气体产生,并发现D中蜡烛熄灭;关闭C 打开E时,则看到G中蜡烛燃得更亮,且F中盛放固体为淡黄色.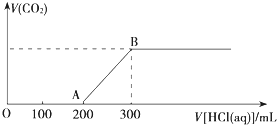 向100mL 3mol?L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.
向100mL 3mol?L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.