题目内容
4.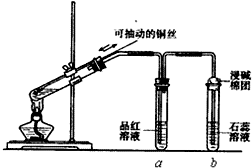 某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.请回答下列问题:
(1)写出铜与浓硫酸反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑.
(2)试管a、b分别检验生成气体的性质,写出观察到的现象及其作用.
试管a中的现象是品红溶液褪色,作用是证明二氧化硫具有漂白性.
试管b中的现象是紫色石蕊试液变红,作用是证明二氧化硫溶于水显示酸性.
(3)试管b管口塞一团浸有烧碱溶液的棉花,其作用是吸收逸出的SO2气体,防止污染空气,相关的反应是(请写离子方程式)SO2+2OH-=SO32-+H2O;
(4)如图用可抽动的铜丝符合化学实验“绿色化学”的原因是通过调节铜丝的高度,可以控制参加反应的铜与浓硫酸的接触面积,从而控制SO2产生的量,减少SO2的污染.
分析 (1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水;
(2)二氧化硫具有漂白性,能够使品红溶液褪色;二氧化硫为酸性氧化物,溶于水显示酸性;
(3)氢氧化钠吸收逸出的SO2气体,防止污染空气;
(4)通过调节铜丝的高度,控制参加反应的铜与浓硫酸的接触面积,从而控制SO2产生的量.
解答 解:(1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;
(2)二氧化硫具有漂白性,能够使品红溶液褪色,所以试管a中品红溶液褪色,目的是证明二氧化硫具有漂白性;二氧化硫属于酸性氧化物,溶于水后溶液显示酸性,能够使紫色的石蕊试液变红,
故答案为:品红溶液褪色;证明二氧化硫具有漂白性;紫色石蕊试液变红;证明二氧化硫溶于水显示酸性;
(3)二氧化硫属于酸性氧化物且有毒,不能直接排空,用氢氧化钠吸收逸出的SO2气体,防止污染空气,反应离子方程式为:SO2+2OH-=SO32-+H2O,
故答案为:吸收逸出的SO2气体,防止污染空气;SO2+2OH-=SO32-+H2O;
(4)通过调节铜丝的高度,可以控制参加反应的铜与浓硫酸的接触面积,从而控制SO2产生的量,减少SO2的污染,符合化学实验“绿色化学”,
故答案为:通过调节铜丝的高度,可以控制参加反应的铜与浓硫酸的接触面积,从而控制SO2产生的量,减少SO2的污染.
点评 本题考查浓硫酸、二氧化硫的性质实验,难度不大,注意掌握二氧化硫气体的性质及检验方法,有利于提高学生灵活应用基础知识的能力,注意二氧化硫不能漂白酸碱指示剂.

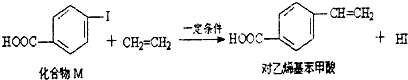
| A. | 对乙烯基苯甲酸的分子式为C9H10O2 | |
| B. | 对乙烯基苯甲酸的同分异构体共有三种 | |
| C. | 对乙烯基苯甲酸即属于羧酸,又属于烯烃 | |
| D. | 二者均可发生取代反应和聚合反应 |
| X | Y | ||
| Z | W |
| A. | 原子半径由小到大的顺序为X<Y<Z<W | |
| B. | Y元素最高价氧化物对应的水化物化学式为H3YO4 | |
| C. | X、Z两种元素的氧化物中所含化学键类型相同 | |
| D. | Y最简单气态氢化物比Y相邻周期同主族元素气态氢化物更加稳定 |
| A. | 1 mol/L | B. | 0.1 mol/L | C. | 0.01 mol/L | D. | 10 mol/L |