题目内容
14.(1)二氧化硫是一种酸性氧化物,具有酸性氧化物的通性.用化学方程式表示二氧化硫具有酸性氧化物的三个化学方程式:SO2+H2O?H2SO3;SO2+CaO=CaSO3;SO2+2NaOH=Na2SO3+H2O;SO2+Na2CO3=Na2SO3+CO2等.(2)SO2中的S为+4价,它既具有氧化性又具有还原性.将SO2通入溴水中,溴水褪色,该反应的化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr;
将SO2通入氢硫酸(H2S的水溶液)中,写出其化学方程式SO2+2H2S=3S↓+2H2O.
(3)SO2还具有漂白性,下列变化体现SO2具有漂白作用的是C
A、SO2能使紫色石蕊试液变化
B、SO2能使溴水褪色
C、SO2能使品红溶液褪色
D、SO2能使酸性高锰酸钾溶液褪色.
分析 (1)酸性氧化物能与水、碱、碱性氧化物以及盐发生反应;
(2)二氧化硫具有还原性,能够与溴水发生氧化还原反应;二氧化硫与硫化氢反应生成硫单质,证明二氧化硫具有氧化性;
(3)二氧化硫与品红反应,使品红褪色,表现漂白性.
解答 解:(1)酸性氧化物能与水、碱、碱性氧化物以及盐发生反应,则反应的方程式有SO2+H2O?H2SO3、SO2+CaO=CaSO3、SO2+2NaOH=Na2SO3+H2O、以及SO2+Na2CO3=Na2SO3+CO2↑都能表现的酸性氧化物的性质,
故答案为:SO2+H2O?H2SO3; SO2+CaO=CaSO3;SO2+2NaOH=Na2SO3+H2O;SO2+Na2CO3=Na2SO3+CO2等;
(2)二氧化硫具有还原性,能够与溴水发生氧化还原反应,方程式为SO2+Br2+2H2O=H2SO4+2HBr,二氧化硫与硫化氢反应生成硫单质,反应的方程式为SO2+2H2S=3S↓+2H2O,
故答案为:SO2+Br2+2H2O=H2SO4+2HBr;SO2+2H2S=3S↓+2H2O;
(3)A、SO2为酸性氧化物,使紫色石蕊试液变红,故A错误;
B、SO2具有还原性,可使溴水褪色,故B错误;
C、SO2能使品红溶液褪色,表现漂白性,故C正确;
D、SO2具有还原性,可使酸性高锰酸钾溶液发生氧化还原反应而褪色,故D错误.
故答案为;C.
点评 本题考查了二氧化硫的还原性、漂白性、酸性氧化物的化学性质,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,注意相关知识的积累,难度不大.

练习册系列答案
相关题目
5.同温同压下等质量的SO2和CO2相比较,下列各项正确的是( )
| A. | 原子个数之比为1:1 | B. | 物质的量之比为1:1 | ||
| C. | 体积之比为11:16 | D. | 分子数之比为1:1 |
2.下列哪种方法可以制取镁( )
| A. | MgO+Al | B. | 电解熔融的MgCl2 | C. | 加热MgCl2 | D. | MgO+C(高温) |
6.下列反应中,不属于氧化还原反应的( )
| A. | NO+NO2+2NaOH=2NaNO2+H2O | B. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | ||
| C. | CuO+2HNO3═Cu(NO3)2+H2O | D. | 2FeCl2+Cl2=2FeCl3 |
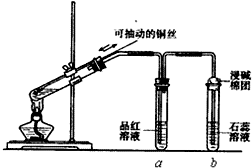 某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.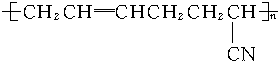 ,则这种高分子化合物的单体的结构简式是CH2=CHCH=CH2、CH2=CHCN.
,则这种高分子化合物的单体的结构简式是CH2=CHCH=CH2、CH2=CHCN.