题目内容
【题目】绿矾(FeSO47H2O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为______(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为______(填>、<、=)40%。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO320克)配制稀硫酸,若用SO3nH2O表示20%的发烟硫酸,则n=______(保留两位小数)。
(3)某厂废水中含1.00×10﹣3mol/L的Cr2O72-,其毒性较大.某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合价为+3,Fe的化合价依次为+3、+2).欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4.理论上需要加入______g FeSO47H2O。
(4)硫酸亚铁铵[(NH4)2SO4FeSO46H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量.现取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下:
10NO3﹣+3Cu2S+16H+→6Cu2++10NO↑+3SO42﹣+8H2O
8NO3﹣+3CuS+8H+→3Cu2++3 SO42﹣+8NO↑+4H2O
剩余的稀硝酸恰好与48mL 2mol/L (NH4)2Fe(SO4)2溶液完全反应.
已知:NO3﹣+3Fe2++4H+→NO↑+3Fe3++2H2O
试计算混合物中CuS的质量分数(保留两位小数)。______________
【答案】7.14molL﹣1 > 0.77 2.78 33.33%
【解析】
(1)根据![]() 计算出密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度;假设密度相同,混合后质量分数为40%,由于硫酸的质量分数越大,溶液中含有的硫酸的质量越大,所以混合后硫酸的质量分数大于40%;
计算出密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度;假设密度相同,混合后质量分数为40%,由于硫酸的质量分数越大,溶液中含有的硫酸的质量越大,所以混合后硫酸的质量分数大于40%;
(2)20%发烟硫酸可表示为SO3nH2O,通过整理即为:nH2SO4(1-n)SO3,根据20%发烟硫酸中H2SO4和SO3的质量关系可得:98n:80(1-n)=(1-20%):20%,解出n即可;
(3)根据Cr原子计算Cr0.5Fe1.5FeO4的物质的量,结合Cr0.5Fe1.5FeO4的物质的量利用Fe原子守恒计算FeSO47H2O质量;
(4)先根据(NH4)2Fe(SO4)2的物质的量计算与其反应的硝酸的物质的量,设固体混合物中两固体的质量,根据两固体的质量计算需要的硝酸的物质的量,然后列式计算出两固体的质量,根据质量分数公式计算即可。
(1)密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度为![]() ≈7.14mol/L;假如50%的硫酸与30%的硫酸密度相同,则混合后硫酸的质量分数为40%,由于50%的硫酸的密度大于30%的硫酸,所以混合后溶液中硫酸的质量偏大,硫酸的质量分数大于40%;
≈7.14mol/L;假如50%的硫酸与30%的硫酸密度相同,则混合后硫酸的质量分数为40%,由于50%的硫酸的密度大于30%的硫酸,所以混合后溶液中硫酸的质量偏大,硫酸的质量分数大于40%;
(2)20%发烟硫酸可表示为SO3nH2O,通过整理即为:nH2SO4(1n)SO3,根据20%发烟硫酸中H2SO4和SO3的质量关系可得:98n:80(1n)=(120%):20%,解得n=0.77;
(3)1L废水中含![]() =1.00×103mol,根据Cr原子、Fe原子守恒,可得:
=1.00×103mol,根据Cr原子、Fe原子守恒,可得:![]() ~4Cr0.5Fe1.5FeO4~10FeSO47H2O,
~4Cr0.5Fe1.5FeO4~10FeSO47H2O,
所以理论上n(FeSO47H2O)=10n(![]() )=1.00×103mol×10=0.01mol,
)=1.00×103mol×10=0.01mol,
所以m(FeSO47H2O)=0.01mol×278g/mol=2.78g;
(4)48mL(NH4)2Fe(SO4)2溶液完全反应需要硝酸的物质的量为:
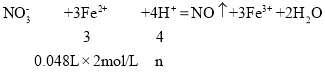
解得:n=0.128mol,所以消耗的硝酸的物质的量为0.128mol,故与固体混合物反应的硝酸的物质的量为:0.4mol0.128mol=0.272mol,
设Cu2S的物质的量xmol,CuS的物质的量为ymol,160x+96y=8.64g①,
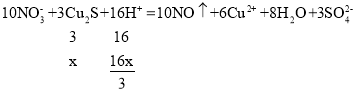

![]() ②
②
由①②解得:x=0.036mol,y=0.03mol,
合物中CuS的质量分数为![]() ≈33.33%,因此混合物中CuS的质量分数为33.33%。
≈33.33%,因此混合物中CuS的质量分数为33.33%。

 阅读快车系列答案
阅读快车系列答案