题目内容
15.溴化碘(IBr)的化学性质类似于卤素单质,试回答下列问题:(1)溴化碘的电子式是
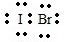 ,它是由极性共价键形成的极性分子.
,它是由极性共价键形成的极性分子.(2)溴化碘和水反应生成了一种三原子分子,该分子的电子式为
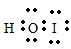 .
.(3)请写出溴的价电子排布式4s24p5.
分析 (1)I和Br的电负性相差不大,形成的化学键是极性共价键,根据共价化合物的成键特点书写电子式;
(2)溴化碘(IBr)的化学性质类似于卤素单质,得知溴化碘和水反应生成次碘酸和溴化氢,结合HClO书写HIO的电子式;
(3)Br为第四周期元素,最外层电子数为7.
解答 解:(1)I和Br的电负性相差不大,形成的化学键是极性共价键,电子式为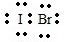 ,是极性共价键形成的极性分子,
,是极性共价键形成的极性分子,
故答案为: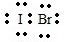 ;极性共价;极性.
;极性共价;极性.
(2)根据卤素单质和水之间反应生成次卤酸和卤化氢,由于Br比I的电负性大,溴化碘和水反应生成次碘酸和溴化氢,三原子分子为次碘酸,属于共价化合物,电子式为: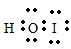 ,故答案为:
,故答案为: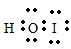 ;
;
(3)Br为第四周期元素,最外层电子数为7,则溴的价电子排布式为4s24p5,故答案为:4s24p5.
点评 本题考查IBr的结构,为高频考点,把握卤素元素及化合物结构与性质的相似性为解答的关键,侧重分析与迁移应用能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.以NA代表阿伏加德罗常数,则关于热化学方程式C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H=-1411kJ•mol-1的说法中,不正确的是( )
| A. | 当12NA个电子转移时,该反应放出1411 kJ的能量 | |
| B. | 当2NA个水分子生成且为液体时,放出1411 kJ的能量 | |
| C. | 当8NA个碳氧共用电子对生成时,放出1411 kJ的能量 | |
| D. | 当8NA个碳氧双键生成时,放出1411 kJ的能量 |
6.下列有关化学用语表示正确的是( )
| A. | 二氧化碳分子的结构式:O-C-O | |
| B. | 氢氧根离子的电子式: | |
| C. | 氯原子的结构示意图: | |
| D. | 中子数为146、质子数为92 的铀(U)原子${\;}_{92}^{146}$U |
20.工业上可用黄铜矿(CuFeS2)冶炼铜,同时还可得到多种物质.工业冶炼铜的化学方程式是:8CuFeS2+2lO2 $\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2
(1)CuFeS2中Fe的化合价为+2,反应中被还原的元素是氧元素和铜元素.
(2)用少量黄铜矿冶炼铜产生的炉渣(主要含Fe2O3、FeO、SiO2、Al2O3)模拟制铁红(Fe2O3),进行如下实验.
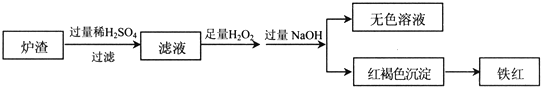
①滤液中的阳离子有Fe3+、Fe2+、H+、Al3+.
②为确认滤液中含Fe2+,下列实验方案和预期现象正确的是c(填序号).
③滤液在酸性条件下,与H2O2反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)冶炼铜过程中产生大量的SO2可用于制硫酸,尾气可用纯碱溶液吸收.已知用1L1mol/L的纯碱溶液吸收SO2,生成n(Na2SO3):n(NaHSO3)=1:2,则吸收的SO2物质的量是1.5mol.
(1)CuFeS2中Fe的化合价为+2,反应中被还原的元素是氧元素和铜元素.
(2)用少量黄铜矿冶炼铜产生的炉渣(主要含Fe2O3、FeO、SiO2、Al2O3)模拟制铁红(Fe2O3),进行如下实验.

①滤液中的阳离子有Fe3+、Fe2+、H+、Al3+.
②为确认滤液中含Fe2+,下列实验方案和预期现象正确的是c(填序号).
| 实验方案 | 预期现象 | |
| a | 加NaOH溶液 | 产生白色沉淀,变灰绿再变红褐 |
| b | 先加KSCN溶液,再加氯水 | 先无明显现象,后变红 |
| C | 加酸性KMnO4溶液 | 紫色褪去 |
| d | 先加氯水,再加KSCN溶液 | 溶液先变黄,再变红 |
(3)冶炼铜过程中产生大量的SO2可用于制硫酸,尾气可用纯碱溶液吸收.已知用1L1mol/L的纯碱溶液吸收SO2,生成n(Na2SO3):n(NaHSO3)=1:2,则吸收的SO2物质的量是1.5mol.
7.下列叙述中,正确的是( )
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| D. | 1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多 |
4.将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品.
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是②③④(填序号).
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是Br2+Na2CO3+H2O NaBr+NaBrO3+NaHCO3,吸收1mol Br2时,转移的电子数为$\frac{5}{3}$mol.
(3)海水提镁的一段工艺流程如图:

浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的离子方程式为Ca2++SO42-=CaSO4↓,产品2的化学式为Mg(OH)2,1L浓海水最多可得到产品2的质量为69.6g.
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式Mg+2H2O$\frac{\underline{\;通电\;}}{\;}$Mg(OH)2+H2↑.
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是②③④(填序号).
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是Br2+Na2CO3+H2O NaBr+NaBrO3+NaHCO3,吸收1mol Br2时,转移的电子数为$\frac{5}{3}$mol.
(3)海水提镁的一段工艺流程如图:

浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/g/L | 63.7 | 28.8 | 144.6 | 46.4 |
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式Mg+2H2O$\frac{\underline{\;通电\;}}{\;}$Mg(OH)2+H2↑.