题目内容
17.举世瞩目的中国探月工程三期再入返回试验器于2014年10月24日凌晨成功发射,为实现月球采样和首次地月往返踏出了成功的第一步.探月工程三期的主要目标是实现无人自动采样返回,突破月面采样、月面上升、月球轨道交会对接等核心关键技术.已知所用火箭推进剂为肼 (N2H4)和过氧化氢(H2O2),火箭箭体一般采用钛合金材料.请回答下列问题:
(1)N2H4、H2O2分子中电负性最大的元素在周期表中的位置为第二周期第ⅤⅠA族,第一电离能最大的元素为N.
(2)钛的原子序数为22,其基态电子排布式示意图为
 .
.(3)1mol N2H4分子中含有的共价键数目为3.01×1024.
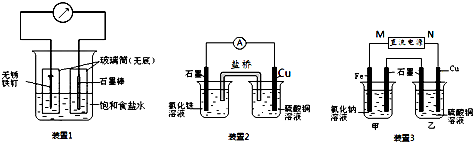
(4)H2O2分子结构如图1,其中心原子杂化轨道为sp3,估计它难溶于CS2,简要说明原因H2O2为极性分子,CS2为非极性溶剂,所以H2O2不能溶解在CS2中.
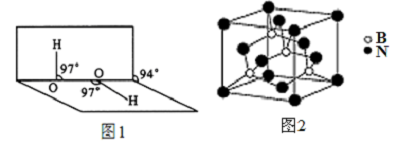
(5)氮化硼其晶胞如图2所示,则处于晶胞顶点上的原子的配位数为4,若立方氮化硼的密度为ρ g•cm-3,阿伏加德罗常数为NA,则两个最近N原子间的距离为$\frac{\sqrt{2}}{2}×\root{3}{\frac{100}{{N}_{A}ρ}}$cm.
分析 (1)N2H4、H2O2分子中N、H、O三种元素,氧元素的电负性最大,同周期从左向右第一电离能增大,从上向下第一电离能减小,据此答题;
(2)钛的原子序数为22,根据核外电子排布规律画出电子排布式示意图;
(3)N2H4分子中氮氮之间有一个共价键,氮氢之间都有共价键,据此判断共价键数目;
(4)根据H2O2分子中氧原子的价层电子对数判断其中心原子杂化方式,根据相似相溶原理答题;
(5)根据氮化硼晶胞图判断处于晶胞顶点上的原子的配位数,根据V=$\frac{m}{ρ}$计算晶胞的体积,进而确定晶胞的边长,晶体中最近的两个N原子的距离为底面对角线的一半.
解答 解:(1)N2H4、H2O2分子中N、H、O三种元素,氧元素的电负性最大,位于周期表中第二周期第ⅤⅠA族,同周期从左向右第一电离能增大,从上向下第一电离能减小,所以第一电离能最大的元素为N,
故答案为:第二周期第ⅤⅠA族;N;
(2)钛的原子序数为22,核外电子排布式示意图为 ,
,
故答案为: ;
;
(3)N2H4分子中氮氮之间有一个共价键,氮氢之间都有共价键,所以1mol N2H4分子中含有的共价键数目为3.01×1024,
故答案为:3.01×1024;
(4)根据H2O2分子中氧原子的价层电子对数为$\frac{6+1+1}{2}$=4,所以氧原子杂化方式为sp3,H2O2为极性分子,CS2为非极性溶剂,根据相似相溶原理,H2O2不能溶解在CS2中,
故答案为:sp3;H2O2为极性分子,CS2为非极性溶剂,所以H2O2不能溶解在CS2中;
(5)根据图知,顶点上的每个B原子和四个N原子形成共价键,所以B原子的配位数是4;该晶胞中B原子个数是4,N个数=$\frac{1}{8}$×8+6×$\frac{1}{2}$=4,晶胞体积=$\frac{\frac{4M}{{N}_{A}}}{ρ}$=$\frac{100}{{N}_{A}ρ}$cm3,晶胞边长=$\root{3}{\frac{100}{{N}_{A}ρ}}$cm,晶胞底面对角线长=$\sqrt{2}$×$\root{3}{\frac{100}{{N}_{A}ρ}}$cm,距离最近的两个N原子的距离为底面对角线的一半,所以两个最近N原子间的距离=$\frac{\sqrt{2}}{2}×\root{3}{\frac{100}{{N}_{A}ρ}}$cm,
故答案为:4; $\frac{\sqrt{2}}{2}×\root{3}{\frac{100}{{N}_{A}ρ}}$.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化轨道、物质的性质、晶胞结构与计算等,需要学生具备扎实的基础,难度中等.

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案下列有关对爱迪生蓄电池的推断错误的是( )
| A. | 放电时,Fe作负极,发生氧化反应 | |
| B. | 放电时,NiO2作正极,发生还原反应 | |
| C. | 蓄电池的电极应浸入碱性电解质溶液中 | |
| D. | 充电时,充电机的正极接在该蓄电池的负极 |
| A. | 20mL 3mol/L 的X溶液 | B. | 20mL 2mol/L 的X溶液 | ||
| C. | 10mL 4mol/L的X溶液 | D. | 10mL 2mol/L的X溶液 |
| A. | 当12NA个电子转移时,该反应放出1411 kJ的能量 | |
| B. | 当2NA个水分子生成且为液体时,放出1411 kJ的能量 | |
| C. | 当8NA个碳氧共用电子对生成时,放出1411 kJ的能量 | |
| D. | 当8NA个碳氧双键生成时,放出1411 kJ的能量 |
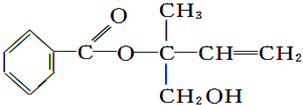
| A. | X的分子式为C12H16O3 | |
| B. | 可用酸性高锰酸钾溶液区分苯和X | |
| C. | X在一定条件下能发生水解、酯化、加成等反应 | |
| D. | 在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2加成 |
| A. | NaClO属于共价化合物 | |
| B. | ClO-与Ca2+、Fe2+、Al3+ 能大量共存 | |
| C. | 1L 0.1mol?L-1NaClO溶液中ClO-的数目为0.1NA | |
| D. | “84”消毒液在空气中久置变质发生了氧化还原反应 |
| A. | 二氧化碳分子的结构式:O-C-O | |
| B. | 氢氧根离子的电子式: | |
| C. | 氯原子的结构示意图: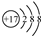 | |
| D. | 中子数为146、质子数为92 的铀(U)原子${\;}_{92}^{146}$U |
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| D. | 1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多 |