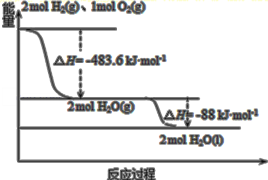
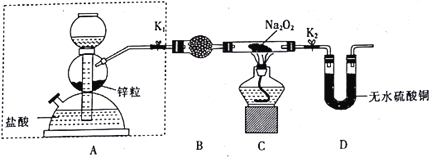
题目内容
【题目】常温下,下列溶液中有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液:c(SO![]() )>c(NH
)>c(NH![]() )>c(Fe2+)>c(H+)
)>c(Fe2+)>c(H+)
B.在 0.1 mol·L-1Na2CO3 溶液中:c(OH-)=c(HCO![]() )+c(H2CO3)+c(H+)
)+c(H2CO3)+c(H+)
C.向Na2C2O4溶液中滴加HCl溶液至pH=7,所得溶液中: c(Cl-)=c(HC2O![]() )+2c(H2C2O4)
)+2c(H2C2O4)
D.pH=12 NaOH溶液与等体积pH=2的醋酸混合后的溶液:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
【答案】AC
【解析】
A.SO42-不水解,NH4+、Fe2+水解,但程度都较小,化学式中离子系数越大,则该离子在溶液中浓度越大,所以离子浓度大小顺序是c(SO42-)>c(NH4+)>c(Fe2+)>c(H+),故A正确;
B.根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),物料守恒得c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),则c(OH-)=c(HCO![]() )+2c(H2CO3)+c(H+),故B错误;
)+2c(H2CO3)+c(H+),故B错误;
C.向Na2C2O4溶液中滴加HCl溶液至pH=7,则c(OH-)=c(H+),且存在电荷守恒式为c(OH-)+ c(Cl-)+ c(HC2O![]() )+2c(HC2O
)+2c(HC2O![]() )=c(H+)+ c(Na+),物料守恒为c(Na+)=2c(HC2O
)=c(H+)+ c(Na+),物料守恒为c(Na+)=2c(HC2O![]() )+2c(HC2O
)+2c(HC2O![]() )+2c(H2C2O4),将物料守恒代入电荷守恒得c(Cl-)=c(HC2O
)+2c(H2C2O4),将物料守恒代入电荷守恒得c(Cl-)=c(HC2O![]() )+2c(H2C2O4),故C正确;
)+2c(H2C2O4),故C正确;
D.0.01molL-1 NaOH溶液与等体积pH=2的醋酸溶液,c(CH3COOH)>c(NaOH),二者混合后,醋酸过量,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(CH3COO-)>c(Na+),溶液中的溶质是醋酸钠和醋酸,醋酸的电离程度很小,所以c(Na+)>c(H+),则溶液中离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D错误;
故答案为AC。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】电解质溶液中存在多种平衡。请回答下列问题:
(1)已知:
化学式 | CH3COOH | HClO |
电离常数(25℃) | 1.8×10-5 | 3.0×10-8 |
物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者C(H+)的大小:a______b(填“>”、“<”或“=”)。
(2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的 __________(填字母)。
A. c(H+) B.  C. c(H+)·c(OH-)
C. c(H+)·c(OH-)
(3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= -lgC(H+),则:

①25℃时,醋酸的电离常数________HX的电离常数。(填“>”、“<”或“=”)
②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)________ HX溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)