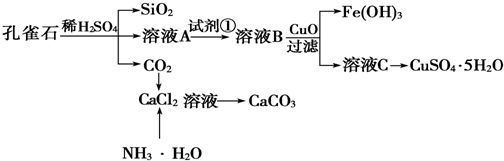
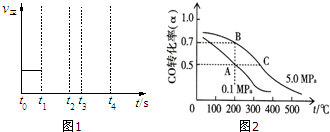
题目内容
9.聚乳酸(PLA),是一种无毒性、可再生、可分解的高分子聚合物塑料.PLA早期用于医学上,作手术缝合线及骨钉等,现在已较广泛应用于一些常见的物品,如:包装袋、纺织纤维.PLA由植物中萃取出淀粉(玉米、甜菜、小麦、甘薯等)或用纤维素(玉米干草、麦秆、甘蔗渣等木质的农业废弃物)经过下列过程制造而成:
根据上述信息,回答下列问题:
(1)淀粉水解生成葡糖糖的化学方程式为(C6H10O5)n+n H2O$\stackrel{催化剂}{→}$n C6H12O6.
(2)已知1mol葡萄糖$→_{(发酵)}^{催化剂}$2mol乳酸,转化过程中无其它反应物、生成物,则乳酸的分子式为C3H6O3.
(3)某研究性小组为了研究乳酸(无色液体,与水混溶)的性质,做了如下实验:
①取1.8g乳酸与过量的饱和NaHCO3溶液反应,测得生成的气体体积为448mL(气体体积已换算为标准状况下体积);
②另取1.8g乳酸与过量的金属钠反应,测得生成的气体体积为448mL(气体体积已换算为标准状况下体积);
由实验数据推知乳酸分子含有羟基、羧基(填官能团名称),从以上条件推知乳酸的结构简式可能为CH3CH(OH)COOH、CH2(OH)CH2COOH.
(4)经现代化学仪器分析,测定乳酸分子中含有一个甲基,请写出乳酸分子之间通过酯化反应生成的六元环状化合物的结构简式
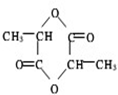 .
.
分析 (1)根据信息淀粉水解生成葡萄糖结合质量守恒书写化学方程式;
(2)根据信息1mol葡萄糖$→_{(发酵)}^{催化剂}$2mol乳酸,转化过程中无其它反应物、生成物结合质量守恒书写化学式;
(3)根据n=$\frac{m}{M}$计算出1.8g乳酸的物质的量,能与过量的饱和NaHCO3溶液反应,说明1个乳酸分子中含有含有一个羧基,另取1.8g乳酸与过量的金属钠反应,测得生成的气体体积为448mL(气体体积已换算为标准状况下体积),则乳酸分子中另一个官能团是醇羟基,据此解答;
(4)经现代化学仪器分析,测定乳酸分子中含有一个甲基,说明醇羟基位于中间碳原子上,根据酯化反应的原理书写六元环状化合物;
解答 解:(1)淀粉水解生成葡糖糖,化学方程式为:(C6H10O5)n+n H2O$\stackrel{催化剂}{→}$n C6H12O6,
故答案为:(C6H10O5)n+n H2O$\stackrel{催化剂}{→}$n C6H12O6;
(2)1mol葡萄糖$→_{(发酵)}^{催化剂}$2mol乳酸,转化过程中无其它反应物、生成物,1mol葡萄糖C6H12O6,含6molC,12molH,6molO,转化为2mol乳酸,所以1mol乳酸中含3molC,6molH,3molO,则乳酸的分子式为C3H6O3;
故答案为:C3H6O3;
(3)1.8g乳酸的物质的量n=$\frac{1.8g}{90g/mol}$=0.02mol,取1.8g乳酸与过量的饱和NaHCO3溶液反应,测得生成的气体体积为448mL(气体体积已换算为标准状况下体积);说明乳酸分子中含有含有羧基,反应生成的二氧化碳气体的物质的量n=$\frac{0.448L}{22.4L/mol}$=0.02mol,说明1个乳酸分子中含有含有一个羧基;另取1.8g乳酸与过量的金属钠反应,测得生成的气体体积为448mL(气体体积已换算为标准状况下体积)生成氢气的物质的量n=$\frac{0.448L}{22.4L/mol}$=0.02mol,1个乳酸分子中含有含有一个羧基,0.02mol乳酸含有0.02mol羧基与金属钠反应生成0.01mol氢气,则乳酸分子中另一个官能团是醇羟基,0.02mol乳酸含有0.02mol醇羟基,与金属钠反应生成0.01mol氢气,乳酸的结构简式可能为 CH3CH(OH)COOH、CH2(OH)CH2COOH;
故答案为:羟基、羧基;CH3CH(OH)COOH、CH2(OH)CH2COOH;
(4)乳酸的结构简式可能为 CH3CH(OH)COOH、CH2(OH)CH2COOH,经现代化学仪器分析,测定乳酸分子中含有一个甲基,说明醇羟基位于中间碳原子上,乳酸的结构简式为CH3CH(OH)COOH,2个乳酸分子在一定条件下可发生酯化反应生成六元环状化合物,反应方程式为:2CH3CH(OH)COOH$→_{加热}^{催化剂}$ +2H2O;
+2H2O;
故答案为: .
.
点评 本题主要考查了乳酸的结构的推导,掌握有机物官能团的性质是解答本题的关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 燃烧反应 | B. | 加成反应 | C. | 取代反应 | D. | 裂解反应 |
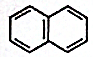 ,它与硝酸反应,可生成苯环上的一硝基取代物( )
,它与硝酸反应,可生成苯环上的一硝基取代物( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | 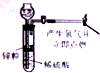 制备并检验氢气的可燃性 | B. | 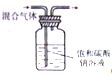 除去CO2中的HCl | ||
| C. | 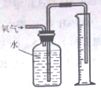 测量O2的体积 | D. | 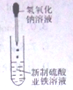 制备氢氧化亚铁并观察其颜色 |