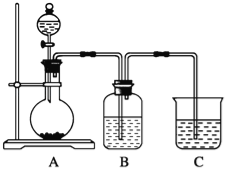
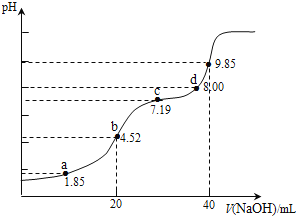
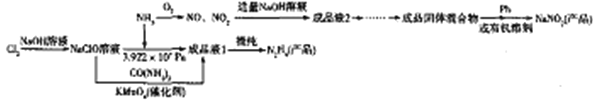
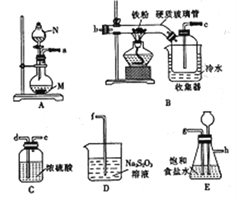
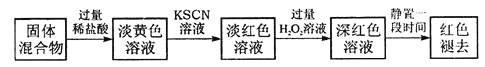
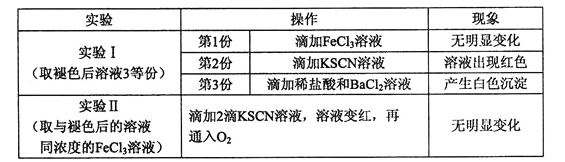
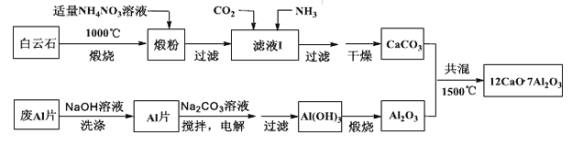
题目内容
【题目】氨气是重要的化工原料
(1)已知: N2(g)+O2(g)= 2NO(g) △H = +180.5kJ·mol-1
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H = -905kJ·mol-1
2H2(g)+O2(g)= 2H2O(g) △H = -483.6kJ·mol-1
写出氨气在高温高压催化剂条件下生成氮气和氢气的热化学方程式:
;如果在1L密闭容器中,3mol NH3 在等温条件下充分反应,2min后达到平衡,平衡时的反应热为92.4kJ ,则在这段时间内v(H2)= ;保持温度不变,将起始NH3的物质的量调整为8mol,平衡时NH3的转化率为 。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
A.增大压强 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂
【答案】(1)2NH3(g)![]() N2(g)+3H2(g)ΔH=+92.4kJ·mol-1;
N2(g)+3H2(g)ΔH=+92.4kJ·mol-1;
1.5mol.L-1.min-1,50%;(2)C。
【解析】
试题分析:(1)①N2(g)+O2(g)=2NO(g),
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g),
③2H2(g)+O2(g)=2H2O(g),(②-①×2-3×③)/2,
得出2NH3(g)![]() N2(g)+3H2(g)ΔH=+92.4kJ·mol-1;生成92.4kJ的热量生成H2的物质的量为3mol,根据化学反应速率的表达式,v(H2)=3/(1×2)mol/(L·min)=1.5mol/(L·min);2NH3(g)
N2(g)+3H2(g)ΔH=+92.4kJ·mol-1;生成92.4kJ的热量生成H2的物质的量为3mol,根据化学反应速率的表达式,v(H2)=3/(1×2)mol/(L·min)=1.5mol/(L·min);2NH3(g)![]() N2(g)+ 3H2(g)
N2(g)+ 3H2(g)
起始: 3 0 0
变化: 2 1 3
平衡: 1 1 3
根据平衡常数的表达式,K= 3×1/1=3, 2NH3(g)![]() N2(g)+ 3H2(g)
N2(g)+ 3H2(g)
起始: 8 0 0
变化: 2x x 3x
平衡: 8-2x x 3x
K=3x×x/(8-2x)=3 ,解得x=2,NH3的转化率为2×2/8×100%=50%;(2)A、增大压强,反应速率增大,根据勒夏特列原理,平衡向逆反应方向移动,故错误;B、升高温度,增大反应速率,此反应是放热反应,升高温度,平衡向逆反应方向进行,故错误;C、增大氧气的浓度,反应速率增大,增大反应物的浓度,平衡向正反应方向进行,故正确;D、使用催化剂,增大反应速率,但对平衡无影响,故错误。