题目内容
【题目】酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15 g /100 mL。莫尔法是较简单的一种测量Cl-含量的方法。现采用该法测量某市售酱油是否符合NaCl含量标准要求。实验原理如下(25℃):Ag++ Cl-=" AgCl" (白色)Ksp(AgCl)=1.8×l0-10
2 Ag++ Cr042-= Ag2Cr04(砖红色)Ksp(Ag2Cr04)=1.2×10-12
准确移取酱油样品5.00 mL稀释至100 mL,从其中取出10.00 mL置于锥形瓶中,再向其中加入适量的铬酸钾溶液,以0.1000 mol/L的硝酸银标准溶液滴定,重复实验三次。
(1)样品稀释过程中,用 移取酱油样品,应在 中定容,还需用到的玻璃
仪器有_____________。
(2)标准硝酸银溶液用棕色滴定管盛装的原因是__________。滴定中眼睛应注视 ,出现 即达到滴定终点。

(3)滴定结束时,滴定管中液面如上图所示,则读数为_____________。
(4)若三次消耗硝酸银标准溶液的平均体积为12.50 mL,则稀释后的酱油中NaCl的浓度为 mol/L,该市售酱油是否符合NaCl含量标准 (填“符合”或“不符合”)。
【答案】(1)酸式滴定管或移液管 100 mL容量瓶 烧杯、玻璃棒、胶头滴管
(2)硝酸银见光易分解 试剂瓶中颜色变化 淡红色沉淀,不再消失
(3)12.70mL(4)0.1250 不符合
【解析】试题分析:(1)准确移取液体用酸式滴定管或移液管,稀释至100mL,应在100 mL容量瓶中定容,还需用到的玻璃仪器有烧杯、玻璃棒、胶头滴管。
(2)硝酸银不稳定,见光易分解,所以标准硝酸银溶液用棕色滴定管盛装。滴定中眼睛应注视试剂瓶中颜色变化,反应中先生成白色氯化银沉淀,当出现淡红色沉淀,半分钟不再消失即达到滴定终点。
(3)滴定管的精度为0.01mL,读数为12.70mL。
(4)设稀释后的酱油中NaCl的浓 度为cmol/L,
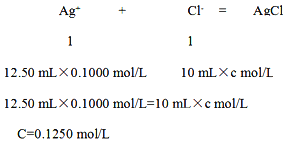
(0.1250 mol/L×0.01L×58.5g/mol) ×10÷5×100=14.625 <15 g /100 mL
该市售酱油是否符合NaCl含量标准不符合。

【题目】I.已知拆开或形成1 mol化学键所吸收或放出的能量叫做该化学键的键能,单位kJ·mol-1。白磷在氧气中燃烧的化学方程式可用结构式表示为如图所示:
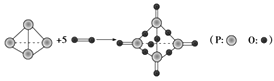
试根据下表中的化学键键能计算0.1molP4(白磷)在氧气中充分燃烧放出能量_____kJ。
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | 198 | 360 | 498 | 585 |
Ⅱ.化学能在一定条件下能够转化为电能,构成原电池。
(1)根据构成原电池的本质判断,如下反应可以设计成原电池的是_________(填序号)。
A. 2FeBr2 + 3Cl2 = 2FeCl3+2Br2
B. Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
C. 2H2O = 2H2↑+O2↑
D. Cu+2AgNO3 = 2Ag+Cu(NO3)2
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验。
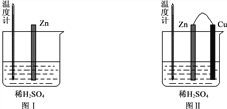
有关实验现象,下列说法正确的是:_____________(填序号)。
图Ⅰ中气泡产生在锌棒表面,Ⅱ中产生在铜棒表面
图Ⅰ和图Ⅱ的气泡均产生在锌棒表面
两图中生成气体的速率几乎一样快
图Ⅱ中产生气体的速度比Ⅰ快
温度计显示的均为室温
图Ⅱ中温度计的示数高于图Ⅰ的示数
图Ⅰ中温度计的示数高于图Ⅱ的示数
图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
(3)铅蓄电池是最常见的二次电池,放电时的化学方程式为:Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O。负极反应式为____________________,一段时间后,负极增重48克,转移电子_______mol。
(4)如图是甲烷燃料电池原理示意图,回答下列问题:
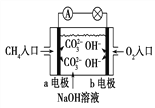
①电池的负极反应式为: ____________。
②电池工作一段时间后电解质溶液的pH__________(填“增大”“减小”或“不变”)。
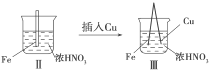
【题目】在通风厨中进行下列实验:下列说法不正确的是( )
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
A. Ⅰ中气体由无色变为红棕色的化学方程式:2NO+O2===2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化膜,阻止Fe进一步反应
C. 对比Ⅰ、Ⅱ中的现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中的现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化