题目内容
5.下列有关同分异构体数目的叙述中,正确的是( )| A. | C5H12有2种同分异构体 | |
| B. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得物质共有6种 | |
| C. | C8H10中只有三种属于芳香烃的同分异构体 | |
| D. | CH3CH2CH2CH3光照下与氯气反应,只生成一种一氯代烃 |
分析 A.根据碳链异构书写同分异构体;
B.根据含3个碳原子的烷基有正丙基和异丙基两种,结合甲苯苯环上含有3种氢原子来回答;
C.分子式为C8H10的芳香烃,分子中含有1个苯环,其不饱和度=$\frac{2×8+2-10}{2}$=4,故侧链为烷基,若有1个侧链,为-CH2-CH3,有一种;若有2个侧链,为-CH3,有邻、间、对三种;
D.有几种等效氢原子就有几种一氯代烃.
解答 解:A.C5H12有3种同分异构体:CH3-CH2-CH2-CH2-CH3; ;
; ,故A错误;
,故A错误;
B.甲苯苯环上含有3种氢原子,含3个碳原子的烷基有正丙基和异丙基两种,即甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种,故B正确;
C.分子式为C8H10的芳香烃,分子中含有1个苯环,其不饱和度=$\frac{2×8+2-10}{2}$=4,故侧链为烷基,若有1个侧链,为-CH2-CH3,有一种;若有2个侧链,为-CH3,有邻、间、对三种,故符合条件的结构共有4种,故C错误;
D.CH3CH2CH2CH3有两种氢原子,所以一氯代烃有2种,故D错误.
故选B.
点评 本题考查同分异构体的书写与判断,题目难度中等,注意烷基的异构与等效H的判断.

练习册系列答案
相关题目
8.下列物质反应后经过过滤,反应液质量增大的是( )
| A. | 少量铁粉加入AgNO3溶液中 | |
| B. | 少量Na2O2粉末加入CuSO4溶液中 | |
| C. | 少量BaSO4粉末加入饱和Na2CO3溶液中 | |
| D. | 少量Al2(SO4)3粉末加入Ba(OH)2溶液中 |
16.孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物.以孔雀石为原料可制备CuCl2•3H2O及纯碱,流程如图.
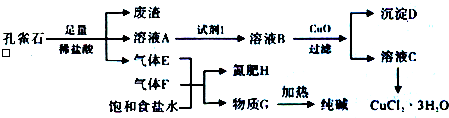
且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如下表所示.回答下列问题:
(1)孔雀石研磨的目的是增大固体表面积,从而增大反应速率.
(2)孔雀石的主要成分与足量稀盐酸反应的化学方程式为Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑.
(3)使用上图中“试剂1”的目的是将溶液中的Fe2+转化为Fe3+,试剂B宜选用BD(填选项序号).
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)加入CuO作用是调节溶液pH,使Fe3+转化为沉淀予以分离.则pH的范围为3.2≤pH<4.7.
(5)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中,其中,应先通入气体是F、NH3(填代号及对应物质的化学式).
(6)由溶液C获得CuCl2•3H2O,需要经过蒸发浓缩、冷却结晶、过滤等操作.
(7)已知:常温下Cu(OH)2的Ksp=2×10-20.计算Cu2++2H2O?Cu(OH)2+2H+反应平衡常数5×10-9.

且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如下表所示.回答下列问题:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| PH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
(2)孔雀石的主要成分与足量稀盐酸反应的化学方程式为Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑.
(3)使用上图中“试剂1”的目的是将溶液中的Fe2+转化为Fe3+,试剂B宜选用BD(填选项序号).
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)加入CuO作用是调节溶液pH,使Fe3+转化为沉淀予以分离.则pH的范围为3.2≤pH<4.7.
(5)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中,其中,应先通入气体是F、NH3(填代号及对应物质的化学式).
(6)由溶液C获得CuCl2•3H2O,需要经过蒸发浓缩、冷却结晶、过滤等操作.
(7)已知:常温下Cu(OH)2的Ksp=2×10-20.计算Cu2++2H2O?Cu(OH)2+2H+反应平衡常数5×10-9.
13.已知Fe(s)+H2SO4(aq)=FeSO4(aq)+H2(g)△H<0,则下列关于该反应的叙述不正确的是( )
| A. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| B. | 上述热化学方程式中的△H的值与反应物的用量有关 | |
| C. | 该反应的化学能可以转化为电能 | |
| D. | 此反应构成的原电池中,正极可以是碳棒、铜或锌 |
20.下列各组物质中,不能按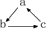 关系相互转化的是(“→”表示一步完成)( )
关系相互转化的是(“→”表示一步完成)( )
 关系相互转化的是(“→”表示一步完成)( )
关系相互转化的是(“→”表示一步完成)( )| 选项 | A | B | C | D |
| a | SiO2 | NaOH | HNO3 | Cu |
| b | Na2SiO3 | Na2CO3 | NO | CuSO4 |
| c | H2SiO3 | NaHCO3 | NO2 | Cu(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
10.某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
| A. | 在自然界中只以化合态的形式存在 | B. | 单质常用作光导纤维 | ||
| C. | 最高价氧化物不与酸反应 | D. | 气态氢化物比甲烷稳定 |
14.下列关于元素周期表的说法正确的是( )
| A. | 18个纵横代表18个族,7个主族、8个副族 | |
| B. | 短周期共有32种元素 | |
| C. | 元素周期表共有七个横行代表七个周期 | |
| D. | 第IA族全部是金属元素 |
15.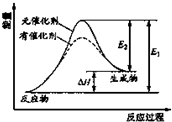 某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )
某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )
 某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )
某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )| A. | 该反应为放热反应 | |
| B. | 催化解能改变反应的焓变 | |
| C. | 催化解能降低反应所需活化能,增大活化分子百分数 | |
| D. | 逆反应的活化能大于正反应的活化能 |
 .
.