题目内容
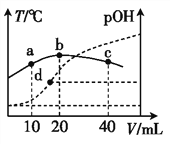
【题目】CO可用于合成甲醇,下图是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH________0(填“>”“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。
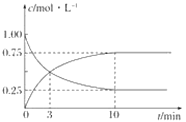
③在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2 ,经测得CO和CH3OH(g)的浓度随时间变化如下图所示。则该反应的平衡常数为______________。
④若容器容积不变,下列措施可增加CO转化率的是________(填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
【答案】 < > 12 b
【解析】①反应CO(g)+2H2(g)CH3OH(g)中,根据图中的信息可知先拐先平温度高:T2>T1,温度越高CO转化率越小,说明升温平衡逆向进行,逆反应为吸热反应,所以正反应是放热反应,△H<0。故答案为:<;
②对于放热反应,温度越高,平衡逆向进行,化学平衡常数越小,T2>T1,所以K1>K2。故答案为:>;
③在T1温度下,往体积为1L的密闭容器中,充入1mol CO和2mol H2,平衡状态下CO浓度为0.25mol/L,CH3OH(g)平衡浓度为0.75mol/L,列平衡三段式:
K=![]() =12。故答案为:12;
=12。故答案为:12;
④a、正反应为放热反应,容积不变,升高温度,平衡逆向移动,甲醇产率降低,故a错误;b、将CH3OH从体系中分离,平衡正向移动,甲醇产率增大,故b正确;c、使催化剂不会引起化学平衡的移动,甲醇的转化率不变,故c错误;d、若容积不变,充入He,使体系总压强增大,各组分的浓度不变,化学平衡不移动,甲醇的转化率不变,故d错误。故答案为:b。

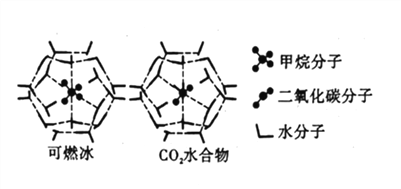
【题目】20世纪末,科学家发现海底存在大量天然气水合物晶体。在天然气水合物晶体中,有甲烷、氧气、二氧化碳、硫化氢、稀有气体等,它们在水合物晶体里是装在几个水分子构成的笼内,因而又称为笼状化合物。
(1)区分晶体和非晶体最可靠的科学方法是___________。
(2)基态C原子中,核外电子占据的最高能层的符号是______,该能层最高能级电子的电子云轮廓形状为________。
(3)H2S分子中中心原子的杂化方式为_______。H2S中H-S-H的键角比CH4中H-C-H的键角_______(填“大”“小”或“相等”)。
(4)CH4、CO2与H2O形成的笼状结构如图所示,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
物质 | 分子直径(nm) | 分子与H2O的结合能(kJ/mol) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中存在的作用力有_____________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表分析,该设想的依据是_____________。
(5)已知稀有气体化合物XeF2的空间构型如图所示,据此判断中心原子Xe的杂化方式为_______(填序号)。
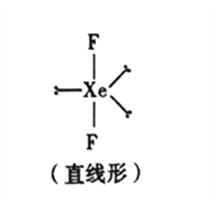
A.sp杂化 B.sp2杂化 C.sp3杂化 D.sp3d杂化
(6)氧气的晶体结构与CO2相似,晶体中若以一个分子为中心,其周围有_____个紧邻的分子,若紧邻的两个分子之间距离为anm,列式表示氧气晶体的密度为______g/cm3。