题目内容
【题目】下表为周期表前20号元素中某些元素的有关数据:
元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
原子半径(10-10m) | 1.86 | 1.52 | 0.66 | 0.53 | 0.77 | 1.10 | 0.99 | 2.31 | 0.70 |
最高价态 | +1 | +1 | —— | +1 | +4 | +5 | +7 | +1 | +5 |
最低价态 | —— | —— | -2 | -1 | -4 | -3 | -1 | —— | -3 |
试回答下列问题:(用对应具体符号或名称表示)
(1)以上9种元素的原子中,还原性最强的是________(名称),写出它的原子结构示意图:___________________ ;
(2)③与④可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:________________________________________(分解反应)。
(3)某元素R的原子半径为1.04×10-10m,该元素在周期表中的位置是_______________
(4)①、③、⑦三种元素形成的离子,其半径由小到大的顺序为_______________
(5)下列事实能说明元素⑦的非金属性比硫元素的非金属性强的是___________。
a.元素⑦形成的单质比硫元素形成的单质的熔点低
b.元素⑦和硫两元素的简单氢化物受热分解,前者的分解温度高
c.元素⑦的单质通入到H2S的溶液中出现浑浊
【答案】钾 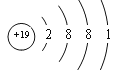 2H2O2
2H2O2 ![]() 2H2O + O2↑ 第三周期第VIA族 r(Na+)<r(O2-)<r(Cl-) bc
2H2O + O2↑ 第三周期第VIA族 r(Na+)<r(O2-)<r(Cl-) bc
【解析】
①、②、④、⑧最高价为+1,属于ⅠA族元素 ,根据原子半径可知①、②、④、⑧分别是Na、Li、H、K;③的化合价为-2,③是O元素;⑥、⑨最高价是+5、最低价为-3,根据原子半径可知⑥、⑨分别是P、N;⑤最高价是+4、最低价为-4,原子半径大于N,所以⑤是C元素;⑦最高价为+7、最低价为-1价,⑦是Cl元素。
(1)金属性越强,还原性越强,以上9种元素的原子中,还原性最强的的是钾;
钾原子核外有19个电子,原子结构示意图: ;
;
(2)O与H形成的10电子分子是H2O,18电子的分子是H2O2,H2O2可分解为H2O和氧气,化学方程式:2H2O2 ![]() 2H2O + O2↑。
2H2O + O2↑。
(3) R的原子半径为1.04×10-10m,介于P、Cl之间,所以R元素是S,S在周期表中的位置是第三周期第VIA族;
(4)电子层数越多半径越大,电子层数相同时,质子数越多半径越小,Na+、O2-、Cl-半径由小到大的顺序为r(Na+)<r(O2-)<r(Cl-);
(5) a.单质的熔点是物理性质,不能比较元素的非金属性,故不选a;
b.非金属性越强,气态氢化物越稳定,所以HCl的分解温度高于H2S,能证明非金属性Cl>S,故选b;
c. 非金属性越强,单质的氧化性越强,氯气通入到H2S的溶液中出现浑浊,说明氯气氧化性大于S,能证明非金属性Cl>S,故选c;

 阅读快车系列答案
阅读快车系列答案



