题目内容
【题目】钋是原子序数最大的氧族元素,下列有关钋及钋的化合物的推测错误的是( )
A.钋是第116号元素B.钋是能导电的固体
C.钋的氢化物很稳定D.钋可能有两种不同价态的氧化物
【答案】AC
【解析】
A.Po元素原子序数=8+8+18+18+32=84,第84号元素,选项A错误;
B.Po是金属元素,钋是能导电的固体,选项B正确;
C.钋与氢气不能直接化合,其气态氢化物很不稳定,选项C错误;
D.作为氧族元素,钋应有+4和+6两种化合价态,故钋的氧化物至少有两种,选项D正确;
答案选AC。

 名校课堂系列答案
名校课堂系列答案【题目】下图是可逆反应X2(g)+3Y2(g)![]() 2Z(g)在反应过程中的反应速率(v)与时间(t)的关系曲线:
2Z(g)在反应过程中的反应速率(v)与时间(t)的关系曲线:
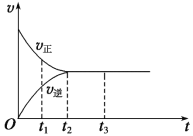
(1)下列叙述正确的是________
A.t1时,只有正方向反应
B.t2时,反应达到限度
C.t2~t3,反应不再发生
D.t2~t3,各物质的浓度不再发生变化
(2)能说明该反应已达到平衡状态的是__________________
A 恒温恒容时,压强不变 B 单位时间内,消耗a mol X2同时生成2a mol Z
C v正(X2)=3v逆(Y2) D X2、Y2、Z的分子数之比为1∶3∶2
E 恒温恒容时,密度不变 F 恒温恒压时,平均相对分子质量不变
(3)在2 L的密闭容器中发生上述反应,n(Z)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
n(Z)/mol | 0 | 0.50 | 0.80 | 0.90 | 0.90 |
计算0~2s内,用Y2表示的化学反应速率为_________________________。
【题目】依据元素周期律,下列推断正确的是( )
A. 酸性:H2SiO3>H2CO3 B. 热稳定性:H2S>H2O
C. 碱性:KOH>Ca(OH)2 D. 若离子半径:R2﹣>M+,则原子序数:R>M
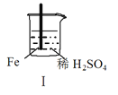
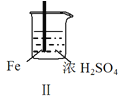
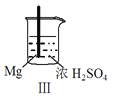
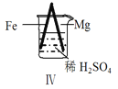
【题目】 Fe和Mg与H2SO4反应的实验如下:
实验 |
|
|
|
|
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
关于上述实验说法不合理的是( )
A.I中产生气体的原因是:Fe + 2H+=Fe2++ H2↑
B.取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C.Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D.Ⅳ中现象说明Mg的金属性比Fe强
【题目】下表为周期表前20号元素中某些元素的有关数据:
元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
原子半径(10-10m) | 1.86 | 1.52 | 0.66 | 0.53 | 0.77 | 1.10 | 0.99 | 2.31 | 0.70 |
最高价态 | +1 | +1 | —— | +1 | +4 | +5 | +7 | +1 | +5 |
最低价态 | —— | —— | -2 | -1 | -4 | -3 | -1 | —— | -3 |
试回答下列问题:(用对应具体符号或名称表示)
(1)以上9种元素的原子中,还原性最强的是________(名称),写出它的原子结构示意图:___________________ ;
(2)③与④可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:________________________________________(分解反应)。
(3)某元素R的原子半径为1.04×10-10m,该元素在周期表中的位置是_______________
(4)①、③、⑦三种元素形成的离子,其半径由小到大的顺序为_______________
(5)下列事实能说明元素⑦的非金属性比硫元素的非金属性强的是___________。
a.元素⑦形成的单质比硫元素形成的单质的熔点低
b.元素⑦和硫两元素的简单氢化物受热分解,前者的分解温度高
c.元素⑦的单质通入到H2S的溶液中出现浑浊