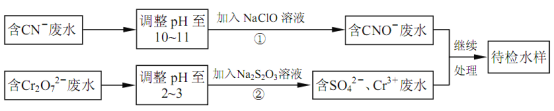
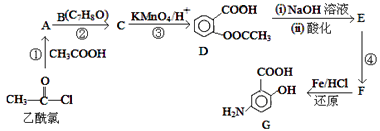
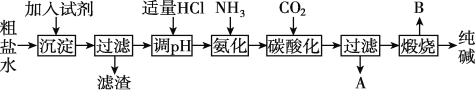
题目内容
【题目】某工业烟气中含有CO、N2、SO2等气体,用Na2SO3溶液吸收并回收SO2的过程如图所示。
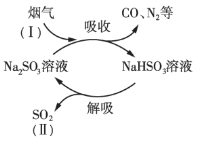
(1)SO2的浓度:Ⅰ______Ⅱ(填“>”或“<”)。
(2)图示过程中可以循环利用的物质是______(填化学式)。
(3)上述吸收过程中发生的主要反应的化学方程式是______。
(4)解吸过程需要加热,在这个过程中常伴有少量SO42-产生。
①证明产物中含SO42-的实验方法是:取少量解吸后的溶液,______(填操作和现象)。
②产生SO42-的原因是______。
【答案】< Na2SO3 Na2SO3+SO2+H2O=2NaHSO3 先加入过量盐酸,再加入BaCl2溶液,有白色沉淀生成 加热过程中,SO32-(或HSO3-)被空气中的氧气氧化成SO42-
【解析】
(1)烟气中含有CO、N2、SO2等气体,通过亚硫酸钠溶液吸收二氧化硫,相当于富集了二氧化硫,过程Ⅱ亚硫酸氢钠分解生成二氧化硫和亚硫酸钠,因此SO2的浓度:I<Ⅱ。
(2)亚硫酸钠吸收二氧化硫,而亚硫酸氢钠受热分解生成二氧化硫、水和亚硫酸钠,因此可以循环利用的是Na2SO3。
(3)亚硫酸钠溶液吸收二氧化硫时发生反应:Na2SO3+SO2+H2O=2NaHSO3。
(4)①一般用盐酸酸化的氯化钡溶液检验硫酸根,则证明产物中含SO42-的实验方法是:取少量解吸后的溶液,先加入过量盐酸,再加入BaCl2溶液,若有白色沉淀生成,即可证明含有SO42-。
②由于SO32-或HSO3-中S为+4价,易被空气中的氧气氧化,从而得到SO42-。

练习册系列答案
相关题目