��Ŀ����
����Ŀ��һ������50kg�Ľ����ˣ�����Լ����2g������2g���������ڲ����Ե��ʵ���ʽ���ڣ�������Fe2+��Fe3+����ʽ���ڡ��������������ױ����գ���ƶѪ�߲�����ʱ��Ӧ���躬Fe2+�������Σ�����������������ά����C����ʹʳ���е�Fe3+��ԭ��Fe2+���������������ա�
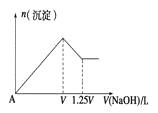
��1���������н��е�![]() ת��ʱ�����е�Fe3+��______________����
ת��ʱ�����е�Fe3+��______________����
��2��������ά����C����ʹʳ���е�Fe3+ ��ԭ��Fe2+����仰ָ����ά����C����һ��Ӧ����_____��������__________________�ԡ�
��3���г����۵�ij����Ƭ�к������Ŀ���ϸС�Ļ�ԭ���ۣ���Щ����������θ���������ת���������Σ��˷�Ӧ�����ӷ���ʽΪ______________________________________��
���𰸡����� ��ԭ ��ԭ Fe+2H+=H2��+Fe2+
��������
��1������Fe3+ת��ΪFe2+��FeԪ�صĻ��ϼ۽��ͣ�Fe3+����������
��2������ά����C����ʹʳ���е�Fe3+��ԭ��Fe2+�������ӱ���ԭ�����������ԣ���������������ά����C���������ǻ�ԭ�������л�ԭ�ԡ�
��3��θ�����Ҫ�ɷ�ΪHCl������HCl��Ӧ�����Ȼ����������������ӷ���ʽΪFe+2H+=Fe2++H2����

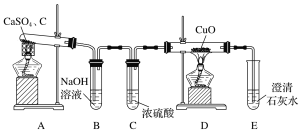
����Ŀ��Ϊ��֤�����ԣ�Cl2��Fe3+��SO2��ij��ѧ�о���ѧϰС������ͼ��ʾװ�ý���ʵ�飨�г�������A�еļ���װ�����ԣ��������Ѿ�������ϣ���
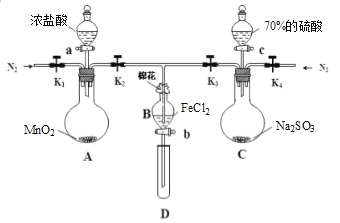
�������ɼ�K1��K4��ͨ��һ��ʱ��N2���ٽ�T�͵��ܲ���B�У�����ͨ��N2��Ȼ��ر�K1��K3��K4��
��������a���μ�һ������Ũ���ᣬ��A������
������B����Һ���ʱ��ֹͣ���ȣ��н����ɼ�K2��
��������b��ʹԼ2mL����Һ����D�Թ��У��������е���������
�������ɼ�K3������c������70%�����ᣬһ��ʱ���н����ɼ�K3��
���������Թ�D���ظ�������������B��Һ�е�������
��1����������Ŀ����__________________________________________________________��
��2�����н������ҺΪ________________��������_____________________________________________ ��
��3��A�з�����Ӧ�Ļ�ѧ����ʽ________________________________________________��
��4�����²���������Һ��Ƶ����ӷ�Ӧ��________________________________________����________��д�Լ���ѧʽ�������������������____________________________________________ ��
��5����˵��������Fe3+��SO2�����ӷ���ʽ��_______________________________��
��6���ס��ҡ�����λͬѧ�ֱ����������ʵ�飬���ǵļ����һ���ܹ�֤��������:Cl2��Fe3+��SO2����_______��������������������������
��������B��Һ�к��е����� | ��������B��Һ�к��е����� | |
�� | ��Fe3+��Fe2+ | ��SO42�� |
�� | ����Fe3+����Fe2+ | ��SO42�� |
�� | ��Fe3+��Fe2+ | ��Fe2+ |